

Effet anti-Listeria des extraits de culture de Lb. brevis DSM 9296 et d'E. faecium 81 dans les fromages de Munster contaminés par L. monocytogenes 4d
Introduction
L'étude réalisée précédemment (chapitre IV) a montré que l'ensemencement de Lb. brevis DSM 9296 et d'E. faecium 81 à la surface des fromages de Munster en début d'affinage permettait d'empêcher le développement ultérieur de L. monocytogenes. Ce traitement a la particularité d'être préventif, la production de bactériocine étant achevée avant que L. monocytogenes ne soit susceptible de se développer.
Un tel traitement présente cependant certains risques et pourrait dans certains cas se révéler insuffisant, par exemple du fait d'une altération des propriétés bactériocinogènes de la souche productrice (émergence de variants non producteurs) ou de l'apparition de phages anti-souches productrices, ou, plus simplement, d'un ensemencement mal conduit (faible implantation de la souche bactériocinogène). Une destruction plus importante que prévue de la bactériocine en fin d'affinage peut également être envisagée si le pH est élevé (>7) (perte par adsorption sur les bactéries ou sur les composants alimentaires et/ou hydrolyse enzymatique), destruction qui pourrait permettre une apparition de L. monocytogenes lors des ultimes lavages. Si la souche test se développe et atteint sa phase stationnaire dans la croûte du fromage, aucune nouvelle production de bactériocine par un nouvel ensemencement de la souche n'est bien sûr envisageable. Si le problème résulte d'une mauvaise implantation de la souche test, ce défaut ne peut être mis en évidence avant l'apparition de L. monocytogenes et dans ce cas un réensemencement, trop tardif, a toutes les chances d'être inefficace.
De tels problèmes n'ont encore jamais été observés lors de l'utilisation industrielle de Lb. brevis DSM 9296. La possibilité de disposer d'un traitement curatif vis-à-vis de L. monocytogenes, par exemple, en incorporant dans les eaux de lavage les substances actives des souches bactériocinogènes, peut cependant se révéler utile. C'est l'objet de ce chapitre au cours duquel deux extraits de culture, ceux de Lb. brevis DSM 9296 et d'E. faecium 81, les plus actifs vis-à-vis de L. monocytogenes, sont testés. Les essais sont réalisés sur des fromages artificiellement contaminés par L. monocytogenes et le traitement par les extraits de culture s'effectue juste après l'apparition de celle-ci dans les fromages.
Matériel et méthodes
I. Souches microbiennes
La souche bactérienne utilisée comme souche indicatrice pour les essais de contamination artificielle des fromages de Munster est L. monocytogenes 4d (voir tableau IX, p. 41). Des ferments d'affinage sont additionnés au fromage de Munster et sont constitués de D. hansenii DH-CH et de B. linens SR3 (Lactolabo, Nancy (France)).
II. Préparation des cultures
La souche indicatrice (L. monocytogenes 4d) destinée à l'ensemencement dans les fromages est d'abord cultivée dans un bouillon TSL pendant 18 h à 37C. La culture est ensuite centrifugée à 2700 g pendant 15 min à 4C et le culot est repris dans le même volume d'eau isotonique (NaCl 0,85%). La suspension bactérienne est diluée au 1/106 dans l'eau de lavage du fromage, de façon à obtenir environ 102 UFC/ml.
Les ferments d'affinage sont rajoutés aux fromages comme cela est pratiqué par l'affineur : dilution au 1/103 d'environ 1010 UFC/g de ferments lyophilisés dans l'eau de lavage du fromage. La concentration obtenue est d'environ 107 UFC/ml.
Les extraits de culture des souches tests sont préparés de la façon déjà décrite (voir p. 43). L'activité de l'extrait de culture de Lb. brevis DSM 9296 est de 17070 UA/ml et celle de l'extrait de culture d'E. faecium 81 est de 1070 UA/ml (mesures par titrage (voir p. 43)).
III. Echantillons
L'étude est menée sur des fromages de Munster au lait pasteurisé, de 11 cm de diamètre. Les échantillons sont des fromages à l'état de blancs pris 3 à 7 j après leur fabrication et gardés en réfrigéré en attendant le début de l'étude. Pour chaque condition de traitement, l'analyse est effectuée sur 5 échantillons pris au hasard parmi les 15 échantillons constituant le lot étudié.
IV. Affinage des fromages, ensemencement des souches et addition des extraits
de culture
L'affinage est réalisé au laboratoire dans une enceinte climatique (Conviron, CMP 3244) reproduisant les conditions de température et d'hygrométrie de l'air régnant dans une cave d'affinage: la température est de 15 C et l'humidité relative est de 95 % (voir annexe VI). Les fromages sont placés sur des claies en acier inoxydable. Tous les lavages des fromages se font par pulvérisation d'eau à leur surface, de façon à reproduire au mieux la technique de lavage pratiquée par l'affineur. Ils sont réalisés à l'aide d'un pistolet pulvérisateur (Rondy, France) relié à un compresseur (corps en aluminium ; contenance 1 l ; buses de 1,5 mm de diamètre ; pression de service 3 bars). Le lavage s'effectue en deux temps : les fromages sont aspergés sur une face et sur la tranche, puis ils sont ensuite retournés avant d'être aspergés sur l'autre face. Les fromages sont ensuite laissés pendant 30 min à 1 h à l'extérieur du lieu de l'affinage pour s'imprégner avant d'être remis à affiner.
Les ensemencements de souches se font par pulvérisation à la surface des fromages des suspensions bactériennes incorporées dans les eaux de lavage. L'ensemencement de L. monocytogenes est effectué après une semaine d'affinage et celui des ferments d'affinage 2 ou 5 j après le début de la période d'affinage.
Le traitement par les extraits de culture est effectué après 8 j d'affinage, en substituant au lavage à l'eau, un lavage à l'extrait de culture.
V. Analyses microbiologiques et mesure du pH
L. monocytogenes est dénombrée dans la croûte du fromage par la méthode FDA modifiée (voir p. 8). L'affinage est suivi par la mesure du pH dans la croûte du fromage (pH-mètre Schott CG-837), ainsi que par le dénombrement dans cette croûte des ferments du rouge et de la flore fongique, respectivement sur milieux TSLA et OGA (voir p. 9 et 10). Pour chaque analyse, effectuée tous les 3 ou 4 j, 5 déterminations sont réalisées sur 5 échantillons de fromages différents.
Résultats et discussion
I. Effets du traitement par l'extrait de culture sur l'évolution de la maturation
des fromages
Le traitement des fromages par un extrait de culture de Lb. brevis DSM 9296 ou d'E. faecium 81 à J8 n'entraîne à l'évidence aucune perturbation de la maturation des fromages. En effet, aucune différence notable, ni du point de vue de la croissance et de la concentration des flores d'affinage (figures 63 et 64), ni du point de vue de l'évolution du pH (figures 65 et 66) n'est observée. Les deux catégories de fromages sont bien affinées, le pH à la fin de la période de maturation étant d'environ 6,5 en surface dans les deux cas.

Figure 63 : Evolution de la flore fongique (![]() ,
, ![]() ) et des bactéries pigmentées (
) et des bactéries pigmentées (![]() ,
, ![]() ), respectivement dans les fromages traités avec l'extrait de culture de Lb. brevis DSM 9296 et dans les fromages témoins au cours de l'affinage
), respectivement dans les fromages traités avec l'extrait de culture de Lb. brevis DSM 9296 et dans les fromages témoins au cours de l'affinage
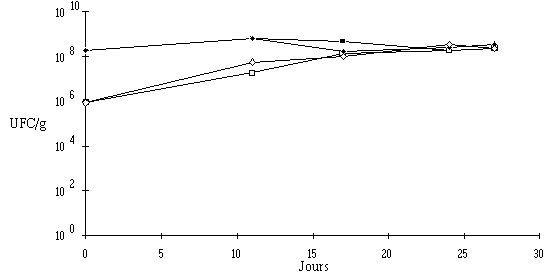
Figure 64 : Evolution de la flore fongique (![]() ,
, ![]() ) et des bactéries pigmentées (
) et des bactéries pigmentées (![]() ,
, ![]() ), respectivement dans les fromages traités avec l'extrait de culture d'E. faecium 81 et dans les fromages témoins au cours de l'affinage
), respectivement dans les fromages traités avec l'extrait de culture d'E. faecium 81 et dans les fromages témoins au cours de l'affinage
Si l'évolution du pH dans la croûte des fromages utilisés pour réaliser l'expérience avec l'extrait de culture d'E. faecium 81 (figure 66) apparaît tout à fait normale, celle du pH des fromages utilisés pour l'expérience avec l'extrait de culture de Lb. brevis DSM 9296 (figure 65) présente deux anomalies (pH initial élevé et faible augmentation du pH au cours de l'affinage), notées aussi bien pour les échantillons témoins que pour les échantillons traités et qui ne sont donc pas imputables au traitement lui-même.
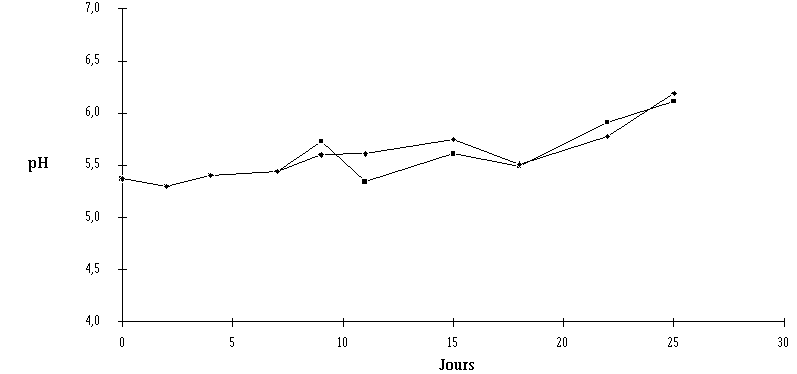
Figure 65 :
Evolution du pH de la croûte des fromages traités avec l'extrait de culture de Lb. brevis DSM 9296 (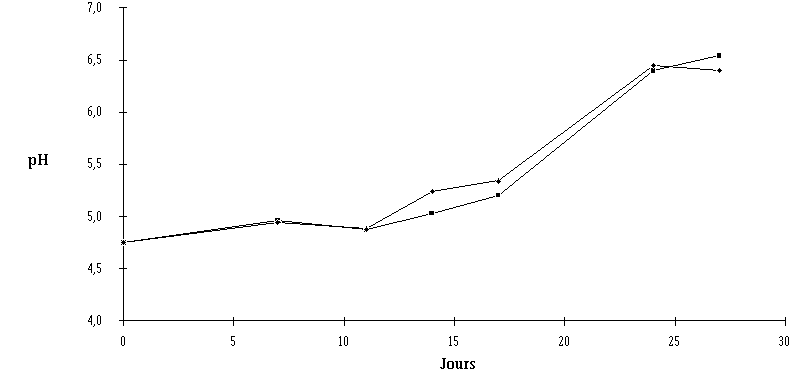
Figure 66 : Evolution du pH de la croûte des fromages traités avec l'extrait de culture d'E. faecium 81 (![]() ) et des fromages témoins (
) et des fromages témoins (![]() ) au cours de l'affinage
) au cours de l'affinage
Le pH initial élevé peut résulter d'un caillage utilisant une grande proportion de la présure pour la fabrication. En effet, un caillé lactique (pH généralement inférieur à 4,6) est plus acide qu'un caillé présure (pH généralement supérieur à 5,15) (Mietton, 1991). Malheureusement, la nature du caillé utilisé par l'industriel pour cette fabrication n'a pu être connue. Le pH initial des fromages peut également être lié à des fluctuations de la valeur nutritive du lait qui provoquent un déséquilibre dans la balance entre les bactéries protéase+ et les bactéries protéase- et donc des différences dans le taux d'acidification (Juillard, 1991) (voir annexe VI). La nature du caillé utilisé, en plus des microorganismes en présence qui peuvent être très variables, influencent également l'évolution du pH au cours de l'affinage (voir annexe VI).
II. Effet du traitement par l'extrait de culture sur la contamination de fromages
de Munster artificiellement contaminés par L. monocytogenes
Les résultats obtenus après traitement à J8 par un extrait de culture de Lb. brevis DSM 9296 et d'E. faecium 81 des fromages de Munster contaminés à J7 par L. monocytogenes 4d sont donnés dans les tableaux XXIV et XXV
Tableau XXIV : Effet d'un traitement des fromages de Munster par l'extrait de culture de Lb. brevis DSM 9296 sur la croissance de L. monocytogenes au cours de l'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)
 a ensemencement des ferments d'affinage. b ensemencement de L. monocytogenes 4d. c traitement avec l'extrait de culture (J8).
a ensemencement des ferments d'affinage. b ensemencement de L. monocytogenes 4d. c traitement avec l'extrait de culture (J8).
L'installation de L. monocytogenes à J7 est satisfaisante dans la plupart des échantillons, aussi bien témoins que traités.
Dans les échantillons témoins, le développement de la bactérie est régulier au cours du temps et sa concentration maximale semble se situer entre 105 et 106 UFC/g.
Avec les échantillons traités, les résultats obtenus sont très différents suivant que le traitement est réalisé avec un extrait de culture de Lb. brevis DSM 9296 ou avec un extrait de culture d'E. faecium 81. Dans le premier cas, une baisse rapide de la contamination des fromages par L. monocytogenes est observée et la plupart des échantillons analysés au cours de l'affinage sont parfaitement décontaminés. La très faible et épisodique contamination de quelques échantillons est très vraisemblablement accidentelle (voir explications p. 122) et sans conséquences ultérieures, puisqu'elle est bien maîtrisée.
Tableau XXV
: Effet d'un traitement des fromages de Munster par l'extrait de culture d'E. faecium 81 sur la croissance de L. monocytogenes au cours l'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)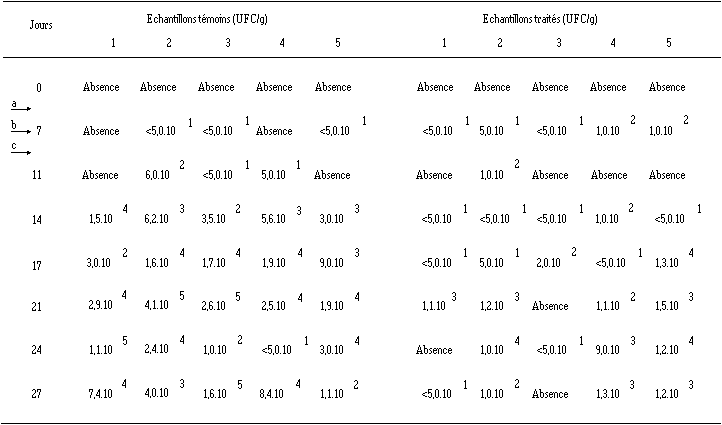 a ensemencement des ferments d'affinage (J5). b ensemencement de L. monocytogenes 4d. c traitement avec l'extrait de culture (J8).
a ensemencement des ferments d'affinage (J5). b ensemencement de L. monocytogenes 4d. c traitement avec l'extrait de culture (J8).
Dans le deuxième cas (traitement des fromages par l'extrait de culture d'E. faecium 81), les résultats sont beaucoup moins satisfaisants. Ils indiquent clairement une contamination des fromages traités, moindre que celle des fromages témoins, mais néanmoins non négligeable. Le traitement réalisé est donc d'une efficacité insuffisante. Plusieurs questions se posent alors. Pourquoi l'extrait de culture d'E. faecium 81 est beaucoup moins actif vis-à-vis de L. monocytogenes dans l'aliment que dans un bouillon de culture ? Pourquoi le traitement des fromages par l'extrait de culture d'E. faecium 81 donne de moins bons résultats que l'ensemencement de cette souche en début d'affinage (voir p. 121) ? Pourquoi l'extrait de culture de Lb. brevis DSM 9296 est-il plus efficace que l'extrait de culture d'E. faecium 81 ?
Une diminution de l'activité des bactériocines lorsque celles-ci passent d'un milieu de culture de laboratoire à un aliment est généralement observée (Asperger et al., 1989 ; Nielsen et al., 1990 ; Valdes-Stauber et al., 1990 ; Sulzer et Busse 1991 ; Schillinger et al., 1991 ; Maisnier-Patin et al., 1992 ; Degnan et Luchansky, 1992). Ainsi, pour la sakacine A (Lb. sake) par exemple, la réduction de la population de L. monocytogenes passe de 1,5 unités logarithmiques dans le bouillon MRS à 0,6 unités logarithmiques dans la viande hachée (Schillinger et al., 1991). Plusieurs explications à cela peuvent être avancées. Nielsen et al. (1990), en testant l'effet de la pédiocine PA-1 (P. acidilactici PAC 1.0) sur L. monocytogenes dans les tranches de viande, ont constaté un déclin de l'activité anti-Listeria et suggéré une complexation de la bactériocine aux protéines de l'aliment ou une dégradation enzymatique. Selon Maisnier-Patin et al. (1992), la moindre activité de la nisine dans le fromage de Camembert serait due à l'adsorption de la bactériocine aux particules solides. Cette étude révèle qu'un faible pourcentage seulement de la nisine produite dans le fromage serait disponible dans la phase aqueuse de l'aliment et donc actif contre L. monocytogenes. Degnan et Luchansky (1992), en mesurant l'activité de la pédiocine AcH ajoutée à des produits carnés, trouvent que la diminution de celle-ci n'est pas seulement liée à la protéolyse, mais que plus la quantité de protéines et/ou de lipides augmente, plus la bactériocine y est complexée et moins elle est récupérable. Il n'est donc pas surprenant que l'entérocine 81 soit moins active dans le fromage de Munster (dont le taux de matière grasse est de 50%) que dans un bouillon de culture. Il faut évoquer également le fait que, contrairement à un bouillon, la distribution de la bactériocine dans un aliment semi-solide ou solide peut être irrégulière, ce qui réduit son efficacité. Les causes de diminution d'activité vis-à-vis de L. monocytogenes de cette bactériocine peuvent donc être multiples (complexation avec les protéines et les lipides, hydrolyse enzymatique...).
Le fait que l'extrait de culture de Lb. brevis DSM 9296 permette d'obtenir de meilleurs résultats que celui d'E. faecium 81 lors du traitement des fromages peut s'expliquer par une activité anti-Listeria (17070 UA/ml) beaucoup plus élevée dans le cas de Lb. brevis DSM 9296 que dans le cas d'E. faecium 81 (1070 UA/ml).
L'explication de la moindre activité anti-Listeria de l'extrait de culture d'E. faecium 81 dans le fromage par rapport à celle enregistrée dans le cas où la souche y est ensemencée est moins évidente. Sans doute, la quantité de bactériocine produite dans l'aliment à 15C (milieu probablement plus favorable à la production) est plus importante que celle reçue quand les fromages sont aspergés d'extrait de culture.
Conclusion
Le traitement par l'extrait de culture de Lb. brevis DSM 9296 des fromages de Munster après leur contamination par L. monocytogenes est aussi efficace que l'ensemencement de la souche productrice. En effet, même si ce traitement n'est effectué qu'une seule fois, aucune reprise de la croissance de L. monocytogenes n'est constatée jusqu'à la fin de l'affinage. Par contre, l'activité bactéricide de l'extrait de culture d'E. faecium 81 est moins nette que lorsque la souche est ensemencée, puisque celui-ci n'a pu empêcher L. monocytogenes d'atteindre 104 UFC/g dans certains échantillons à la fin de l'affinage. Des traitements répétitifs avec l'extrait de culture auraient sans doute été nécessaires pour obtenir un effet équivalent à celui de l'ensemencement de la souche.
Comme dans le cas de l'utilisation des souches productrices, aucun effet défavorable sur l'évolution de l'affinage des fromages, dû au traitement par les extraits de cultures, n'est à signaler. Les fromages traités atteignent en effet un degré de maturation équivalent à celui des fromages témoins à la fin de la période d'affinage.
Alors que dans le cas de l'ajout de la souche bactériocinogène, l'élimination de L. monocytogenes dépend du cycle de croissance de la première, l'utilisation de l'extrait de culture permet d'obtenir un effet immédiat et offre la possibilité d'un traitement a posteriori. Un tel procédé permet également de traiter de façon répétée l'aliment en fonction de sa contamination, et donc de faire face à des recontaminations des fromages de Munster par L. monocytogenes au cours de l'affinage.
Il certain que l'extrait de culture, étant donné sa composition complexe englobant une multitude de produits du métabolisme à partir des constituants du bouillon MRS, n'est pas directement utilisable pour le traitement d'un aliment. D'un point de vue réglementaire, la purification, au moins partielle, des bactériocines est une étape préalable et indispensable à toute utilisation de ces substances en tant qu'additif alimentaire (voir annexe VIII). Bien entendu, l'utilisation de la bactériocine purifiée permettra de mieux maîtriser, qu'avec un extrait de culture, la quantité de ce produit nécessaire lors d'un traitement anti-Listeria.