

Application de l'action anti-L. monocytogenes des bactériocines produites par Lb. brevis DSM 9296 et E. faecium 81 dans les fromages de Munster
Introduction
Lors de l'étude précédente (chapitre 3), il a été montré que, parmi les souches bactériennes productrices de bactériocines anti-Listeria isolées du fromage de Munster, Lb. brevis DSM 9296 et E. faecium 81 étaient a priori les plus intéressantes pour une utilisation dans cet aliment. Un seul ensemencement de ces souches dans le fromage de Munster, en début d'affinage, devrait permettre une production de bactériocines actives en quantités suffisantes pour empêcher l'apparition L. monocytogenes tout au long de la période d'affinage.
Toutefois, bien que l'efficacité de ces souches ait été vérifiée dans les conditions de pH et de température dans lesquelles s'affine le fromage de Munster, il est nécessaire de procéder à des essais sur l'aliment, étant donné l'influence généralement constatée de la composition de l'aliment et de la présence d'autres flores microbiennes sur l'activité antibactérienne des souches bactériocinogènes. Les composants chimiques de l'aliment peuvent réduire l'efficacité des bactériocines en limitant leur diffusion (dans les aliments solides ou semi-solides) ou en induisant des réactions de complexation et des interactions par adsorption, avec les globules gras et les protéines. La présence d'autres microorganismes, principalement dans les produits fermentés, est à l'origine d'une concurrence qui peut gêner énormément l'installation et la croissance de la bactérie bactériocinogène. Il peut également se produire des hydrolyses enzymatiques non spécifiques et des adsorptions à des cellules bactériennes. Pour toutes ces raisons, l'activité bactéricide retrouvée dans les aliments est généralement plus faible que celle constatée dans des milieux de culture de laboratoire. Cela a été constaté pour la plupart des bactériocines testées sur les aliments (Asperger et al., 1989 ; Nielsen et al., 1990 ; Valdes-Stauber et al., 1990 ; Sulzer et Busse 1991 ; Schillinger et al., 1991 ; Maisnier-Patin et al., 1992 ; Degnan et Luchansky, 1992).
Dans les études visant à éliminer L. monocytogenes dans les fromages (Camembert en particulier) par application de souches bactériocinogènes, les différents auteurs (Valdes-Stauber et al., 1990 ; Sulzer et Busse 1991 ; Maisnier-Patin et al., 1992) ont été confrontés à de telles difficultés. Du fait que la contamination des fromages de Camembert est principalement d'origine laitière, les souches bactériocinogènes sont ensemencées comme starter uniques, ce qui a des conséquences défavorables sur la qualité organoleptique des fromages (Daeschel, 1989). Par ailleurs, le fait que les souches bactériocinogènes utilisées ne proviennent généralement pas de l'aliment traité peut aussi avoir pour conséquence une inhibition de certaines bactéries responsables des caractéristiques organoleptiques de l'aliment.
Dans l'étude entreprise, les souches anti-Listeria, isolées à partir du fromage de Munster, peuvent être appliquées directement sur la croûte du fromage, lors d'une opération de lavage en début d'affinage, puisque la contamination par L. monocytogenes n'apparaît qu'au niveau de cette croûte, et seulement après plusieurs jours d'affinage. Dans ces conditions, le développement des souches bactériocinogènes devrait être satisfaisant et ne pas entraîner de perturbation lors de l'affinage du fromage (ces souches ayant été retrouvées naturellement dans l'aliment à des concentrations élevées, 108 UFC/g environ).
Une première série d'expériences, utilisant comme souches test, soit Lb. brevis DSM 9296, soit E. faecium 81, est réalisée entièrement au laboratoire (inoculation des fromages par la bactérie test et par des ferments d'affinage, contamination artificielle par L. monocytogenes et affinage).
Dans deux autres séries d'expériences, au cours desquelles seul Lb. brevis DSM 9296 est utilisé comme souche test, une partie plus ou moins importante des essais est réalisée en cave d'affinage. Dans la deuxième série, les ensemencements de Lb. brevis DSM 9296 et des ferments d'affinage sont effectués en cave, ainsi que le début de l'affinage, la contamination artificielle par L. monocytogenes et la suite de l'affinage étant réalisées au laboratoire. Dans la troisième série, l'ensemencement de Lb. brevis DSM 9296 (effectué en cave d'affinage) est suivi d'une contamination naturelle des fromages par L. monocytogenes lors des lavages réalisés dans les caves d'affinage, l'étude se poursuivant ensuite au laboratoire.
Matériel et méthodes
I. Souches microbiennes
La souche bactérienne utilisée comme souche indicatrice pour les essais de contamination artificielle des fromages de Munster est L. monocytogenes 4d (voir tableau IX, p. 41). Des ferments d'affinage sont additionnés au fromage de Munster et sont constitués de D. hansenii DH-CH et de B. linens SR3 (Lactolabo, Paris (France)).
II. Préparation des cultures
La souche test destinée à l'ensemencement dans les fromages est d'abord cultivée dans un bouillon MRS pendant 18 h à 37C. La culture est ensuite centrifugée à 2700 g pendant 15 min à 4C et le culot est repris dans le même volume d'eau isotonique (NaCl 0,85%). La suspension obtenue est diluée ensuite à un taux déterminé (1/10, 1/103 et 1/106 UFC/ml) dans l'eau de lavage du fromage, de façon à obtenir environ 108 , 105 et 102 UFC/ml respectivement.
Le même mode opératoire est adopté pour la souche indicatrice (L. monocytogenes 4d), le bouillon de culture utilisé étant un milieu TSL. La suspension de L. monocytogenes est diluée au 1/106 dans l'eau de lavage du fromage, de façon à obtenir environ 102 UFC/ml.
Les ferments d'affinage sont rajoutés aux fromages comme cela est pratiqué par l'affineur : dilution au 1/103 d'environ 1010 UFC/g de ferments lyophilisés dans l'eau de lavage du fromage. La concentration obtenue est d'environ 107 UFC/ml.
III. Echantillons
L'étude est menée sur des fromages de Munster au lait pasteurisé, de 11 cm de diamètre. Les échantillons sont des fromages à l'état de blancs pris 3 à 7 j après leur fabrication et gardés en réfrigéré en attendant le début de l'étude. Pour chaque condition de traitement, l'analyse est effectuée sur 5 échantillons pris au hasard parmi les 15 échantillons constituant le lot étudié.
IV. Affinage des fromages et ensemencement des souches
L'affinage est réalisé au laboratoire dans une enceinte climatique (Conviron, CMP 3244) reproduisant les conditions de température et d'hygrométrie de l'air régnant dans une cave d'affinage: la température est de 15 C et l'humidité relative est de 95 % (voir annexe VI). Les fromages sont placés sur des claies en acier inoxydable. Tous les lavages des fromages se font par pulvérisation d'eau à leur surface, de façon à reproduire au mieux la technique de lavage pratiquée par l'affineur. Ils sont réalisés à l'aide d'un pistolet pulvérisateur (Rondy, France) relié à un compresseur (corps en aluminium ; contenance 1 l ; buses de 1,5 mm de diamètre ; pression de service 3 bars).
En vue de comparer l'effet de l'affinage en cave à celui de l'affinage dans l'enceinte climatique, certains essais se déroulent chez l'affineur. Dans ce cas, le lavage des fromages se fait également à l'aide d'un pistolet pulvérisateur (capacité 10 l, pression de service 6 bars). Le lavage, au laboratoire ou chez l'affineur, s'effectue en deux temps : les fromages sont aspergés sur une face et sur la tranche, puis ils sont ensuite retournés avant d'être aspergés sur l'autre face. Les fromages sont ensuite laissés pendant 30 min à 1 h à l'extérieur du lieu de l'affinage pour s'imprégner avant d'être remis à affiner.
Les ensemencements de souches se font par pulvérisation à la surface des fromages des suspensions bactériennes incorporées dans les eaux de lavage. L'ensemencement de la souche bactériocinogène (non effectué pour les fromages témoins) a lieu dès le début de l'affinage ou après 3 j. Celui de L. monocytogenes est effectué après une semaine d'affinage. Quant aux ferments d'affinage, ils sont additionnés 2 ou 5 j après le début de l'affinage.
V. Analyses microbiologiques et mesure du pH
L. monocytogenes est dénombrée dans la croûte du fromage par la méthode FDA modifiée (voir p. 8). L'affinage est suivi par la mesure du pH de la croûte du fromage (pH-mètre Schott CG-837), ainsi que par le dénombrement dans cette croûte des ferments du rouge et de la flore fongique, respectivement sur milieux TSLA et OGA (voir p. 9 et 10). Pour chaque analyse, effectuée tous les 3 ou 4 j, 5 déterminations sont réalisées sur 5 échantillons différents de fromage.
Résultats et discussion
I. Choix des conditions d'ensemencement
1. Souches productrices de bactériocines
Pour être efficaces contre L. monocytogenes (production importante de bactériocines), les souches bactériocinogènes doivent avoir une croissance optimale dans les fromages de Munster, ce qui suppose qu'elles soient ensemencées à une concentration suffisamment faible pour croître, mais aussi suffisamment élevée pour permettre leur installation dans le milieu. A cet effet, une étude préliminaire a permis de montrer, par utilisation de concentrations de 102, 105 et 108 UFC/ml dans l'eau de lavage des fromages, qu'une action bactéricide maximale est obtenue avec une concentration de 105 UFC/ml (résultats non présentés). Les concentrations de bactéries productrices de bactériocines effectivement déposées n'ont pu être déterminées pour des raisons techniques évidentes.
La période d'ensemencement de la souche productrice de bactériocine par rapport à celle de l'apparition normale de L. monocytogenes est également importante. En effet, il faut que la fin de la phase exponentielle de croissance de la bactérie productrice de bactériocine (quantité maximale de substance active) soit atteinte avant que L. monocytogenes n'atteigne des concentrations pour lesquelles la quantité de bactériocine produite serait insuffisante. Aussi, compte tenu de la cinétique de production de bactériocine par Lb. brevis DSM 9296 et E. faecium 81 à 15C (quantité maximale atteinte après 5 j) et de la période d'apparition normale de L. monocytogenes dans les fromages de Munster (7 à 10 j généralement), un ensemencement de la souche test au tout début de la période d'affinage (après 0 à 3 j) paraît a priori adéquat.
2. L. monocytogenes
La période d'ensemencement, ainsi que la concentration de L. monocytogenes ensemencée sont choisies de façon à représenter au mieux son apparition normale dans les caves d'affinage. Ainsi, l'ajout de L. monocytogenes 4d est effectué après 7 j d'affinage en pulvérisant une suspension de L. monocytogenes à 102 UFC/ml à la surface des fromages. Dans ces conditions, les concentrations de L. monocytogenes déposées par gramme de croûte de fromage varient entre <50 UFC/g et 102 UFC/g.
II. Efficacité anti-
Listeria d'E. faecium 81 et de Lb. brevis DSM 9296 lors del'affinage de fromages de Munster artificiellement contaminés par L.
monocytogenes 4d (étude au laboratoire)
1. Effet de l'ensemencement d'E. faecium 81 sur la contamination des fromages par L.
monocytogenes.
L'influence d'une installation d'E. faecium 81 sur la croissance de L. monocytogenes est appréciée en procédant à un ensemencement de la souche productrice de bactériocine à J3 sur des fromages en cours d'affinage. L'installation de L. monocytogenes se fait à J7 et des ferments d'affinage (D. hansenii DH-CH et B. linens SR3) sont additionnées aux fromages à J5. Les résultats obtenus sont donnés dans le tableau XVIII.
L'installation de L. monocytogenes à J7 correspond à des concentrations inférieures à 50 UFC/g dans 3 fromages témoins sur 5 et 2 fromages traités sur 5 (tableau XVIII).
Dans les fromages témoins, le développement de L. monocytogenes est normal puisque cette bactérie atteint des teneurs de 104 UFC/g après 14 j d'affinage. En fin d'affinage, ces teneurs peuvent dépasser 105 UFC/g.
Tableau XVIII :
Effet d'E. faecium 81 ensemencé à J3 dans le fromage de Munster sur la croissance de L. monocytogenes 4d au cours de l'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)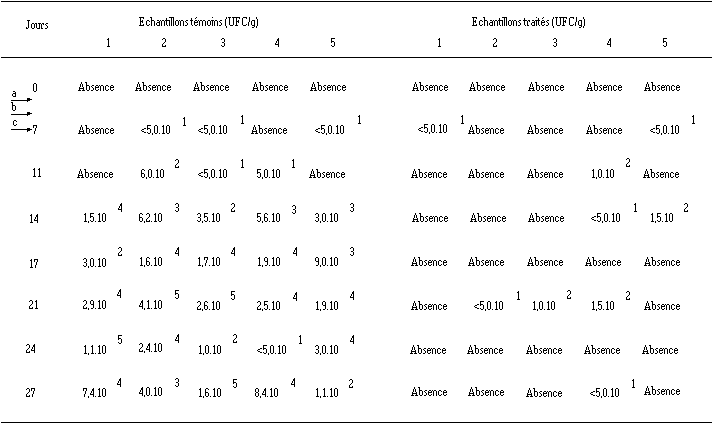
a ensemencement d'E. faecium 81 (J3). b ensemencement des ferments d'affinage (J5). c ensemencement de L. monocytogenes 4d.
La très grande majorité des fromages traités, analysés au cours de l'affinage, ne présentent pas de contamination par L. monocytogenes et les échantillons contaminés le sont toujours à des concentrations faibles. Très vraisemblablement, en raison de la proximité des deux catégories de fromages dans l'enceinte climatique (faible écart entre les claies (15 cm), cette présence épisodique de L. monocytogenes dans les fromages traités résulte d'une contamination accidentelle provenant des fromages témoins par l'intermédiaire des gouttes de condensation et d'eau de lavage). Une autre hypothèse, moins probable, peut être avancée. En effet, selon Northolt (1989), des cellules de L. monocytogenes traitées, ayant survécu à l'action de la bactériocine, mais en mauvais état physiologique, peuvent ne pas être détectées lors de l'enrichissement en bouillon, mais sont susceptibles de récupérer au cours du temps et donc d'être à nouveau comptabilisées.
Etant donné le non-développement ultérieur de ces faibles quantités de L. monocytogenes détectées, il est certain que l'action de la bactériocine produite par E. faecium 81 se poursuit jusqu'à la fin de l'affinage. Ces résultats sont très encourageants et un peu inattendus. En effet, l'étude de la production de bactériocine par E. faecium 81 dans le bouillon MRS a montré qu'elle était achevée après 5 j à 15C, mais que celle-ci était loin d'être optimale à pH 5 (figure 41) et qu'une dégradation complète était observée après 14 j à un pH final de 4 (figure 29). Dans l'aliment, son activité bactéricide se maintient donc plus longtemps, en dépit de l'existence d'autres facteurs d'altération (adsorption de la bactériocine à des composants de l'aliment ou à des cellules bactériennes et dégradation par des protéases non spécifiques, produites essentiellement par la flore fongique (Pucci et al., 1988 ; Nielsen et al., 1990, Maisnier-Patin et al., 1992 ; Muriana, 1993)) et malgré un pH plus élevé. Le maintien de l'activité bactéricide dans le fromage est donc probablement lié à la quantité de bactériocine produite qui serait plus importante que dans un bouillon MRS à 15C, de sorte que, malgré les phénomènes de dégradation et de complexation, une partie notable de la bactériocine reste disponible et active.
L'efficacité d'E. faecium 81 ensemencé au début de l'affinage pour éliminer L. monocytogenes dans le cas d'une contamination aux concentrations habituelles, serait due en premier lieu à une bonne installation de cette bactérie dans le fromage. Ceci est un résultat positif compte tenu des interactions multiples et complexes ayant lieu entre les microorganismes dans tout produit fermenté, pouvant gêner l'installation d'une nouvelle souche. C'est ainsi que l'étude d'Asperger et al. (1989), sur un fromage à pâte molle et croûte lavée ensemencé de L. monocytogenes puis d'une souche bactériocinogène d'E. faecium (au cours de l'affinage), a montré qu'E. faecium n'a pas pu s'installer dans le fromage pour manifester son action anti-Listeria.
Pour ce qui est de la progression de l'affinage, il n'y a pas de différences importantes entre les échantillons témoins et les échantillons traités. Dans les deux lots, un bon développement de la flore fongique et des bactéries pigmentées a lieu (figure 54). Le pH de la croûte passe d'environ 4,7 dans les fromages blancs à environ 6,5 en fin d'affinage (figure 55). Cette évolution est tout à fait normale.

Figure 54 : Evolution de la flore fongique (![]() ,
, ![]() ) et des bactéries pigmentées (
) et des bactéries pigmentées (![]() ,
, ![]() ), respectivement dans des fromages ensemencés d'E. faecium 81 et dans les fromages témoins au cours de l'affinage
), respectivement dans des fromages ensemencés d'E. faecium 81 et dans les fromages témoins au cours de l'affinage
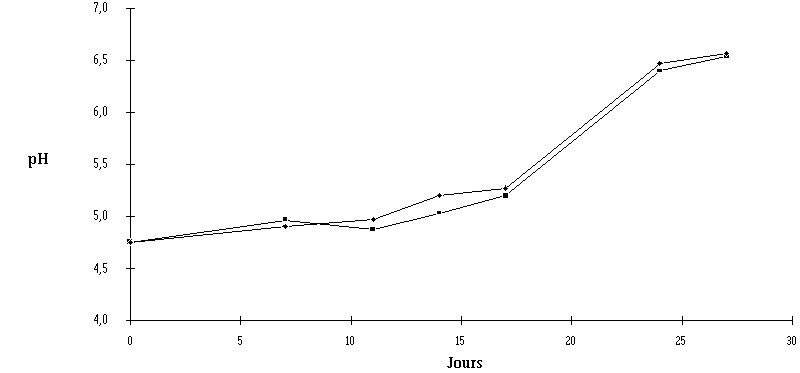
Figure 55 : Evolution du pH de la croûte des fromages ensemencés d'E. faecium 81 (![]() ) et des fromages témoins (
) et des fromages témoins (![]() ) au cours de l'affinage
) au cours de l'affinage
2. Effet de l'ensemencement de Lb. brevis DSM 9296 sur la contamination des fromages
par L. monocytogenes.
Dans cette étude, un ensemencement unique de Lb. brevis DSM 9296 est pratiqué soit à J0 (jour du début de l'affinage), soit à J3, L. monocytogenes étant ensemencée à J7. Des ferments sont ajoutés à J2. Les résultats obtenus dans les deux expériences sont donnés dans les tableaux XIX et XX.
Tableau XIX :
Efficacité de Lb. brevis DSM 9296 ensemencé dans le fromage de Munster à l'état blanc (J0) sur la croissance de L. monocytogenes 4d au cours de l'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités) a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage. c ensemencement de L. monocytogenes 4d.
a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage. c ensemencement de L. monocytogenes 4d.
Bien que L. monocytogenes soit ensemencée à J7, la bactérie n'est décelée dans les échantillons témoins qu'à partir de J9. Une répartition bactérienne à la fois faible et hétérogène à la surface du fromage serait à l'origine de l'absence constatée de contamination à J7, en ne permettant pas un échantillonnage représentatif. L. monocytogenes atteint en fin d'affinage des concentrations de 1,0.102 à 8,6.104 UFC/g dans 4 échantillons témoins. Dans le 5ème échantillon, L. monocytogenes n'est pas décelée. Le développement de cette bactérie semble moins important que dans l'expérience précédente (tableau XVIII), peut-être parce que le pH de la croûte, dont l'augmentation est faible dans le cas présent, est moins favorable à son développement (voir figure 56, p. 126).
Tableau XX :
Efficacité de Lb. brevis DSM 9296 ensemencé dans le fromage de Munster 3 j après la mise dans l'enceinte climatique sur la croissance de L. monocytogenes 4d au cours de la période d'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)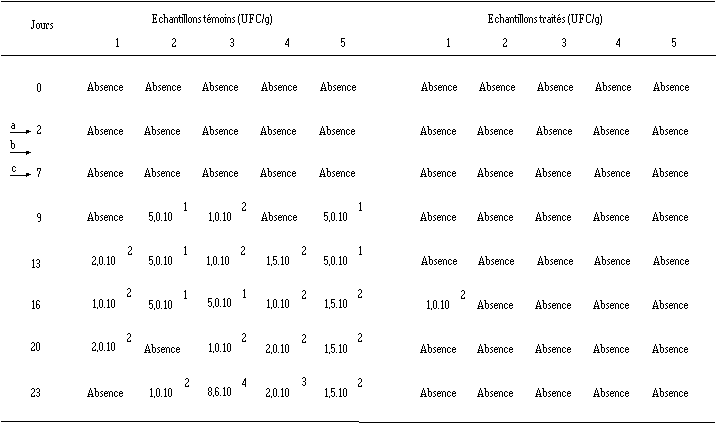 a ensemencement des ferments d'affinage. b ensemencement de Lb. brevis DSM 9296 (J3). c ensemencement de L. monocytogenes 4d.
a ensemencement des ferments d'affinage. b ensemencement de Lb. brevis DSM 9296 (J3). c ensemencement de L. monocytogenes 4d.
Dans les fromages traités, l'action bactéricide de Lb. brevis DSM 9296, aussi bien lorsque celui-ci est ensemencé à J0 que lorsqu'il l'est à J3, est évidente vis-à-vis de L. monocytogenes puisque cette bactérie n'est pratiquement jamais détectée au cours de l'affinage. L'apparition de faibles quantités de L. monocytogenes dans 3 fromages est probablement due, comme cela a déjà été indiqué pour E. faecium 81, à une contamination provenant des fromages témoins, en raison de la proximité des fromages traités et des fromages témoins qui rend presque inévitable une telle contamination (faible écart entre les claies (15 cm)), par l'intermédiaire des gouttes de condensation et d'eau de lavage.
Le fait que, malgré la réapparition épisodique de L. monocytogenes dans certains échantillons, l'activité bactéricide se poursuit jusqu'à la fin de l'affinage montre que la quantité de bactériocine produite reste suffisante pendant toute la durée de l'affinage en dépit d'éventuels réactions de complexation et d'hydrolyse enzymatique dans l'aliment. Apparemment, la production de bactériocine par Lb. brevis DSM 9296 est rapide, puisque la réduction à 4 j de l'intervalle de temps séparant les ensemencements de cette bactérie et de L. monocytogenes n'a pas de conséquences défavorables sur l'efficacité de l'action anti-Listeria.
Par ailleurs, un seul ensemencement de Lb. brevis DSM 9296 au début de l'affinage est à l'évidence suffisant pour assurer une installation de cette bactérie et par conséquent éliminer L. monocytogenes dans le cas d'une contamination telle qu'elle est pratiquée dans cette étude.
Il faut cependant noter (figure 56) que l'évolution du pH (dont la valeur initiale est normale) n'est pas satisfaisante, aussi bien dans la croûte des fromages témoins que dans celle des fromages traités. En ce qui concerne les fromages témoins, le pH dans la croûte augmente très rapidement en début d'affinage pour atteindre une valeur voisine de 6 après 13 j puis baisse ensuite de façon anormale pour se situer à une valeur de l'ordre de 5,5 au terme de l'affinage (23 j). Dans les fromages ensemencés de Lb. brevis DSM 9296, l'augmentation du pH de la croûte dans la dernière partie de l'affinage est très insuffisante.
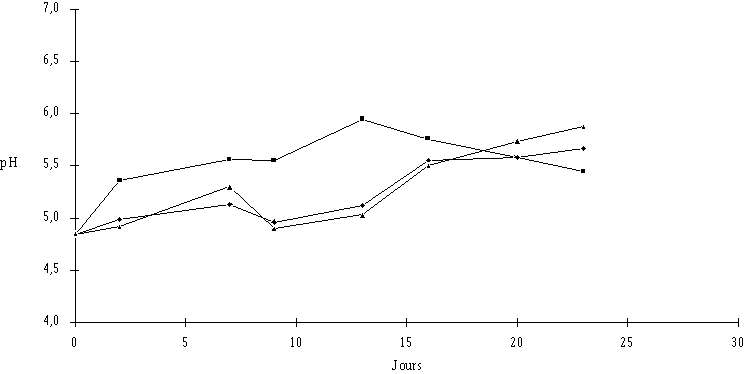
Figure 56: Evolution du pH de la croûte des fromages ensemencés de Lb. brevis DSM 9296 à J0 (![]() ) et à J3 (
) et à J3 (![]() ) et des fromages témoins (
) et des fromages témoins (![]() ) au cours de l'affinage
) au cours de l'affinage
Les conditions d'affinage au laboratoire ne sont pas à mettre en cause dans cette désacidification lente du caillé puisque des essais menés préalablement à cette étude avaient montré une évolution tout à fait normale du pH des fromages affinés dans l'enceinte climatique. Très vraisemblablement, c'est la qualité des fromages blancs utilisés dans ces deux séries d'expériences qui est à l'origine de l'évolution anormale du pH, ce problème ayant été constaté en même temps dans les caves d'affinage utilisant les mêmes caillés. La maturation des fromages est en effet étroitement liée à la nature au type de caillage utilisé et des flores en présence qui peuvent être très variables (voir annexe VI)
Un nouvel essai, réalisé sur un lot de fromage différent, a été effectué. Lors cet essai, Lb. brevis DSM 9296 est ensemencé à J0, les ferments d'affinage à J5 et L. monocytogenes à J7.
Concernant l'évolution de l'affinage des fromages, elle est quasiment identique pour les fromages témoins et traités, le pH de la croûte évoluant en moyenne de 4,7 au début de l'affinage à 6,3 à 6,7 après 27 j (figure 57). Cette augmentation normale du pH reflète un bon développement des flores d'affinage ajoutées ou indigènes. Aucune différence majeure n'est en effet relevée du point de vue de la croissance de la flore fongique et des bactéries pigmentées (figure 58). Il faut noter toutefois qu'à partir du 11ème jour d'affinage, le pH des fromages traités est légèrement supérieur à celui des fromages témoins. Cette différence toutefois ne semble pas significative.
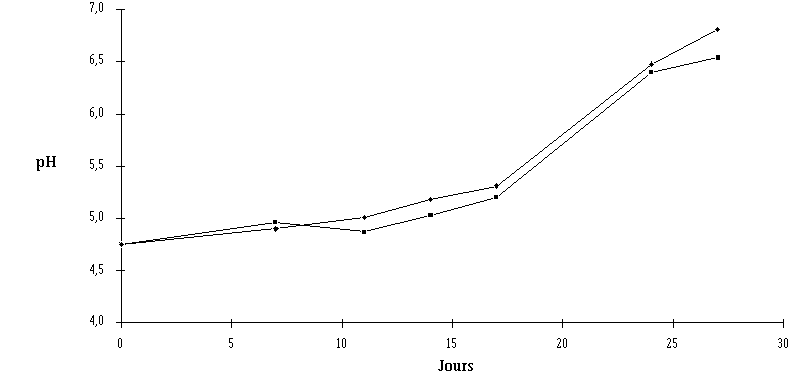
Figure 57 :
Evolution du pH de la croûte des fromages ensemencés de Lb. brevis DSM 9296 (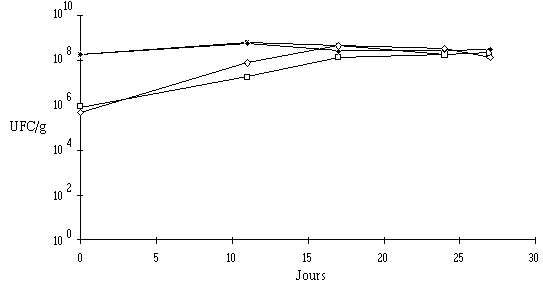
Figure 58 : Evolution de la flore fongique (![]() ,
, ![]() ) et des bactéries pigmentées (
) et des bactéries pigmentées (![]() ,
, ![]() ), respectivement dans les fromages ensemencés de Lb. brevis DSM 9296 et dans les fromages témoins au cours de l'affinage
), respectivement dans les fromages ensemencés de Lb. brevis DSM 9296 et dans les fromages témoins au cours de l'affinage
L'installation de Lb. brevis DSM 9296 dans les fromages de Munster n'a pas d'incidence sur le développement des ferments d'affinage. En effet, la flore fongique n'est pas sensible aux bactériocines, et bactéries pigmentées auraient probablement déjà développé une résistance vis-à-vis de cette bactériocine, Lb. brevis DSM 9296 étant isolé du même milieu.
Les résultats obtenus concernant la contamination par L. monocytogenes des fromages de Munster témoins et traités par Lb. brevis DSM 9296 sont présentés dans le tableau XXI.
Tableau XXI :
Effet de Lb. brevis DSM 9296 ensemencé à J0 dans le fromage de Munster à l'état blanc sur la croissance de L. monocytogenes 4d au cours de l'affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)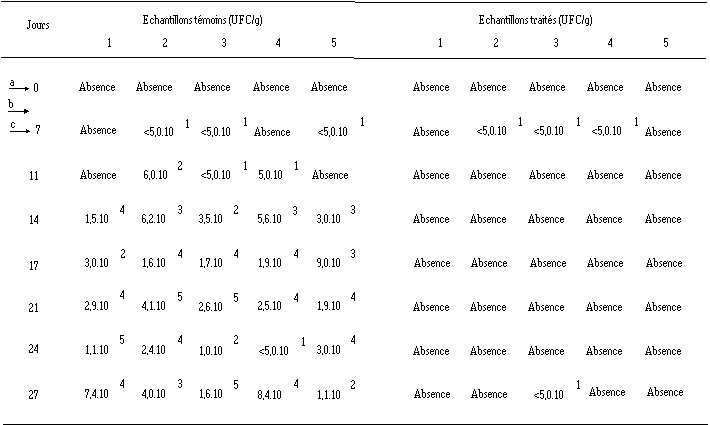 a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage (J5). c ensemencement de L. monocytogenes 4d.
a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage (J5). c ensemencement de L. monocytogenes 4d.
L'installation de la bactérie pathogène à J7 se traduit par des teneurs inférieures à 50 UFC/g dans 3 sur 5 des fromages analysés (traités ou témoins), alors que les autres échantillons ne sont pas contaminés. Cette présence, qui n'est en fait décelée qu'après un procédé d'enrichissement, simule bien la contamination naturelle des fromages de Munster par L. monocytogenes.
Dans les fromages témoins, L. monocytogenes se développe continuellement et les concentrations peuvent atteindre 104 UFC/g après 17 j et 105 UFC/g dans certains échantillons après 21 j.
Dans les fromages ensemencés par Lb. brevis DSM 9296, à une exception près (due vraisemblablement à une recontamination accidentelle (voir p. 122)), aucune présence de L. monocytogenes n'est mise en évidence après la contamination artificielle par Listeria.
L'activité anti-Listeria de Lb. brevis DSM 9296 est donc démontrée dans des fromages de Munster dont l'évolution du pH est normale au cours de l'affinage. Cette activité se maintient jusqu'à la fin de la période d'affinage où le pH est pourtant proche de 7 (en bouillon de culture, il a pourtant été montré (figure 52a) que la stabilité de la brévicine 9296 était moins bonne à pH 7 qu'en milieu plus acide).
III. Efficacité anti-Listeria de l'ensemencement de Lb. brevis DSM 9296 réalisé
en cave lors de l'affinage de fromages de Munster artificiellement
contaminés par L. monocytogenes 4d
Pour cette étude plus complexe à mettre en oeuvre, une seule souche bactériocinogène a été testée. Le choix s'est porté sur Lb. brevis DSM 9296 plutôt que sur E. faecium 81, parce que la souche de Lb. brevis présente une activité anti-Listeria plus marquée, et aussi parce que c'est une bactérie lactique qu'il peut paraître plus normal d'ajouter à un produit laitier qu'un entérocoque.
Le traitement des fromages dans les caves d'affinage est réalisé à l'aide d'un pistolet pulvérisateur d'une capacité de 10 l. Les fromages à l'état de blancs sont ensemencés immédiatement de Lb. brevis DSM 9296. Après 5 j d'affinage, des ferments (D. hansenii DH-CH et B. linens SR3) sont ajoutés. Les échantillons sont ensuite transférés à J6 au laboratoire où ils sont contaminés par L. monocytogenes (J7) et poursuivent leur affinage dans l'enceinte climatique. Les résultats obtenus sont donnés dans le tableau XXII.
Tableau XXII: Effet du traitement des fromages de Munster par Lb. brevis DSM 9296 dans les caves d'affinage sur la croissance de L. monocytogenes 4d au cours de la période d'affinage - cas d'un ensemencement de Lb. brevis DSM 9296 au pistolet pulvérisateur (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)
 a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage (J5). c ensemencement de L. monocytogenes 4d.
a ensemencement de Lb. brevis DSM 9296. b ensemencement des ferments d'affinage (J5). c ensemencement de L. monocytogenes 4d.
L'installation de L. monocytogenes à J7 se traduit par des concentrations généralement inférieures à 50 UFC/g. Un développement normal de L. monocytogenes a lieu dans les fromages témoins dans lesquels les concentrations de cette bactérie en fin d'affinage (24 j) sont comprises entre 103 et 105 UFC/g. Dans les fromages traités, une absence de L. monocytogenes est généralement observée. Une très faible contamination de certains échantillons, vraisemblablement accidentelle (voir p. 122) et rapidement maîtrisée, est cependant notée dans quelques échantillons.
Aucune différence notable concernant l'évolution de la flore fongique et des bactéries pigmentées (figure 59) et l'évolution du pH (figure 60) au cours de l'affinage n'est à signaler entre les fromages traités et les fromages témoins. Dans les deux cas, une maturation normale des fromages est enregistrée.
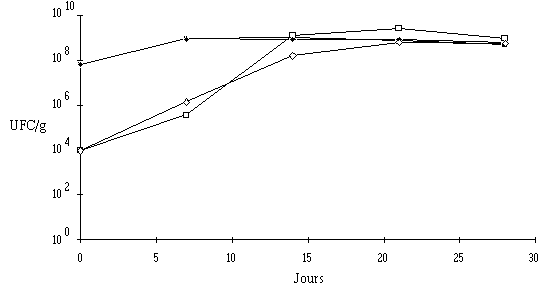
Figure 59 : Evolution de la flore fongique (![]() ,
, ![]() ) et des bactéries pigmentées (
) et des bactéries pigmentées (![]() ,
, ![]() ), respectivement dans les fromages ensemencés de Lb. brevis DSM 9296 chez l'affineur et dans les fromages témoins au cours de l'affinage
), respectivement dans les fromages ensemencés de Lb. brevis DSM 9296 chez l'affineur et dans les fromages témoins au cours de l'affinage
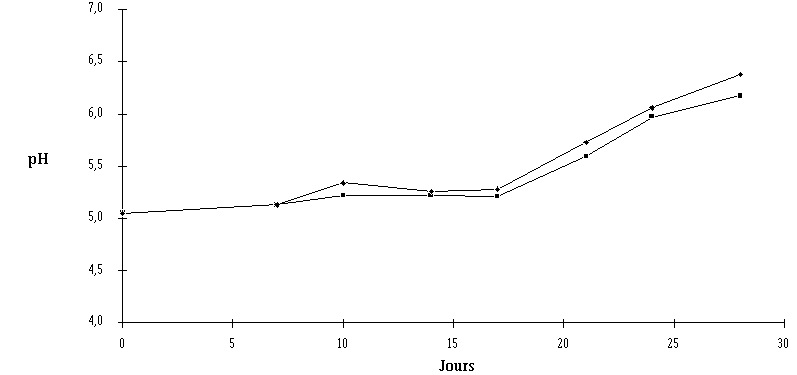
Figure 60 :
Evolution du pH de la croûte des fromages ensemencés de Lb. brevis DSM 9296 chez l'affineur (IV. Efficacité de l'ensemencement de Lb. brevis DSM 9296 réalisé en cave
d'affinage dans des fromages de Munster naturellement contaminés par L.
monocytogenes
L'efficacité anti-Listeria de la brévicine 9296 dans l'aliment n'a été étudiée et démontrée jusqu'à présent que vis-à-vis d'une souche de L. monocytogenes (4d) d'origine alimentaire. Or, les souches contaminant l'aliment peuvent être variées et sont mieux adaptées au milieu que les souches additionnées artificiellement. De plus, comme cela a déjà été constaté (tableau XII, p. 52) et rapporté par d'autres auteurs (Benkerroum et Sandine, 1988 ; Nielsen et al., 1990 ; Motlagh et al., 1992b), les sensibilités des souches indicatrices diffèrent pour une même bactériocine. Il est donc important de vérifier l'effet anti-Listeria de la brévicine 9296 à l'aide de fromages de Munster naturellement contaminés par L. monocytogenes, donc dans lesquels plusieurs souches différentes peuvent être présentes.
Afin de permettre une contamination naturelle des échantillons de fromage destinés à cette étude, une partie de l'affinage se déroule en cave. Les fromages reçus chez l'affineur 6 j après leur fabrication sont ensemencés de Lb. brevis DSM 9296 à J0 et maintenus dans les caves d'affinage jusqu'à J6. L'essai se poursuit ensuite au laboratoire où les fromages continuent leur affinage dans l'enceinte climatique. Les résultats obtenus sont donnés dans le tableau XXIII.
La présence de L. monocytogenes n'est décelée qu'à partir du 7ème jour d'affinage, avec des concentrations inférieures à 50 UFC/g dans 1 échantillon témoin ou traité sur 5 et une concentration de 100 UFC/g dans 1 échantillon témoin sur 5 (tableau XXIII). A partir de J11, une croissance progressive de L. monocytogenes est constatée dans les fromages témoins et se poursuit jusqu'à la fin de l'affinage où des concentrations supérieures à 104 UFC/g peuvent être atteintes. Les concentrations en L. monocytogenes des échantillons témoins dans cette expérience sont cependant moins élevées que celles obtenues à la suite d'une contamination artificielle (voir tableau XXII, p. 130). Dans les échantillons traités, L. monocytogenes n'est pratiquement jamais retrouvée (un seul cas de recontamination, vraisemblablement accidentelle, est noté à J11).
Tableau XXIII
: Effet de l'ensemencement de Lb. brevis DSM 9296 sur la croissance de L. monocytogenes présente naturellement dans les fromages de Munster au cours de leur affinage (les chiffres 1 à 5 représentent les échantillons analysés pour le lot de fromages témoins et le lot de fromages traités)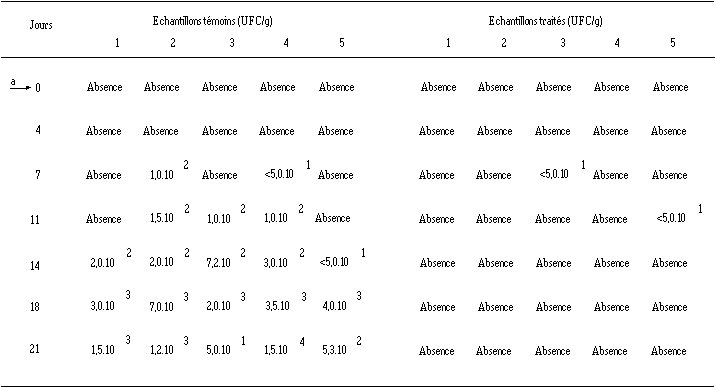 a ensemencement de Lb. brevis DSM 9296
a ensemencement de Lb. brevis DSM 9296
Pour ce qui est de l'évolution des flores d'affinage, mis à part un retard dans le développement des bactéries pigmentées au sein des fromages traités et qui est compensé après 14 j d'affinage, il n'y a pas de différence à noter entre les fromages traités et les fromages témoins (figures 61 et 62).
Une évolution anormalement lente du pH des deux catégories de fromages, vraisemblablement due à la qualité du caillé des fromages étudiés (voir annexe VI) est cependant notée. La faible augmentation du pH n'empêche pas toutefois le développement de L. monocytogenes dans les fromages témoins, ce qui est en accord avec les constatations généralement faites sur la capacité de L. monocytogenes à croître dans des milieux à pH inférieur 5 (Parish et Higgins, 1989 ; Conner et al., 1990 ; Nielsen et al., 1990), mais peut être responsable des faibles concentrations obtenues en fin d'affinage.
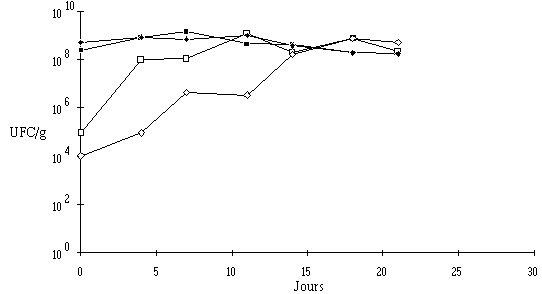
Figure 61 :
Evolution de la flore fongique (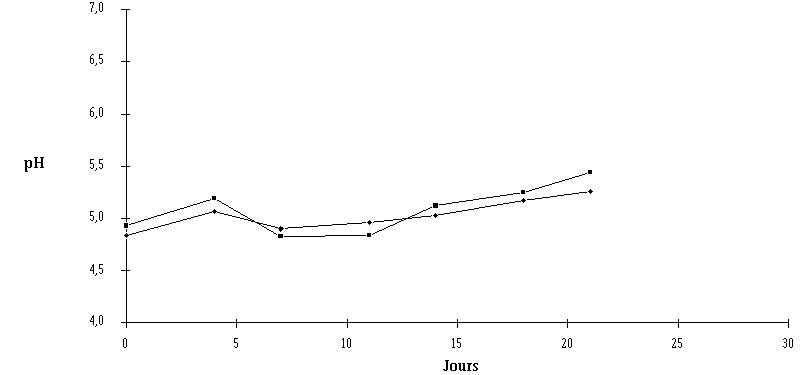
Figure 62 : Evolution du pH de la croûte des fromages ensemencés de Lb. brevis DSM 9296 (![]() ) et des fromages témoins (
) et des fromages témoins (![]() ) au cours de l'affinage
) au cours de l'affinage
Cette étude montre donc qu'une installation précoce de Lb. brevis DSM 9296 au début de l'affinage est suffisante pour faire face aux cas de contamination naturelle survenant dans les caves d'affinage.
Conclusion
Dans les fromages de Munster, la contamination par L. monocytogenes, exclusivement dans la croûte, résulte des lavages répétés effectués au cours de la fabrication. De ce fait, elle n'est généralement détectable qu'après 7 à 10 j d'affinage.
L'ensemencement préventif (en début d'affinage) du fromage de Munster, artificiellement contaminé après 7 j d'affinage par L. monocytogenes 4d, par Lb. brevis DSM 9296 ou par E. faecium 81 permet d'éviter tout développement de cette bactérie au cours de l'affinage. Dans les fromages témoins par contre, les concentrations en L. monocytogenes atteignent fréquemment 105 UFC/g. Aucun effet notable, consécutif à l'ensemencement des fromages par l'une ou l'autre des deux souches bactériocinogènes, sur l'évolution de l'affinage des fromages (pH, flore fongique, ferments du rouge) n'est observé. En fait, l'utilisation de souches bactériennes normalement présentes dans le fromage de Munster (ces souches, ayant été isolées à des concentrations élevées (107 à 108 UFC/g)) et leur ensemencement au cours de l'affinage (donc pas en tant que starter) permettent d'éviter toute modification des qualités microbienne et organoleptique du fromage. Ces résultats ont été obtenus après ensemencement des souches et affinage au laboratoire.
Des travaux plus complets, réalisés exclusivement avec Lb. brevis DSM 9296, ont permis d'obtenir des résultats tout aussi satisfaisants, tout d'abord lorsque l'ensemencement de cette bactérie est effectué dans les caves d'affinage (et la contamination par L. monocytogenes, ainsi que l'affinage au laboratoire), puis lorsque les fromages ensemencés de Lb. brevis DSM 9296 sont naturellement contaminés par L. monocytogenes et partiellement affinés en cave d'affinage.
Les expériences effectuées, lors de contaminations artificielles ou naturelles par L. monocytogenes, l'ont été sans recontamination volontaire au cours de l'affinage. Toutefois, il est apparu que l'activité bactéricide se maintient jusqu'à la fin de la période d'affinage, puisque les recontaminations accidentelles provenant des fromages témoins sont bien maîtrisées.
Pour des raisons circonstancielles, un fabricant industriel de fromages de Munster, confronté régulièrement à d'importantes contaminations de sa production par L. monocytogenes, malgré la mise en place de mesures d'hygiène strictes, a souhaité utiliser le procédé de traitement par Lb. brevis DSM 9296 mis au point au cours de cette étude. Les conséquences en ont été très bénéfiques, puisqu'aucune contamination notable par L. monocytogenes n'a été notée après 12 mois de pratique. Le succès de l'application industrielle du procédé confirme donc les résultats obtenus au laboratoire, concernant l'activité et la vitesse de production de bactériocine par Lb. brevis DSM 9296, ainsi que la stabilité de cette bactériocine dans le fromage tout au long de l'affinage.
Des mises au point techniques concernant notamment la lyophilisation de la souche bactériocinogène et l'installation, dans les caves d'affinage, d'un dispositif de pulvérisation permettant de réaliser un traitement automatisé par Lb. brevis DSM 9296 sont actuellement en cours de réalisation.