Effets du pH et de la température sur l'activité anti-Listeria des souches bactériocinogènes isolées du fromage de Munster et sur la stabilité des bactériocines produites
Introduction
L'étude réalisée précédemment (chapitre 2) avait essentiellement pour objet de rechercher dans des fromages de Munster des souches bactériennes productrices de bactériocines. Six de ces souches ont finalement été isolées. Certains des résultats obtenus, en particulier ceux concernant le titrage de l'activité anti-Listeria des différents extraits de culture (tableau X, p. 47), pourraient laisser penser que la souche Lb. brevis DSM 9296, et à un degré moindre la souche E. faecium 81, seraient beaucoup plus efficaces que les quatre autres souches pour le traitement anti-Listeria des fromages de Munster. Une telle affirmation est très prématurée. En effet, les conditions de pH et de température dans lesquelles ont été réalisées ces expériences (bouillon de culture à 37C et pH 6 ; gélose double couche : MRS pH 6,2/ LA pH 6,8) ne correspondent pas, bien entendu, à celles rencontrées lors de l'affinage du fromage de Munster. Par ailleurs, l'intensité de l'action bactéricide dans un milieu tel que le fromage, du fait de sa composition chimique et de la présence d'autres flores microbiennes, est difficilement prévisible. De nombreux auteurs ont déjà constaté la difficulté de retrouver les effets anti-Listeria d'une souche bactérienne, très nets en milieux de culture de laboratoire, lorsque celle-ci est appliquée à un fromage ou ajoutée à son lait de fabrication (Asperger et al., 1989 ; Valdes Stauber et al., 1990 ; Sulzer et Busse, 1991 ; Maisnier-Patin et al., 1992).
Les éventuelles conséquences sur l'activité anti-Listeria d'une souche bactériocinogène résultant de la nature complexe du fromage, ne seront appréciées que dans le chapitre suivant. Seuls les effets du pH et de la température (étude en bouillon de culture) sur cette activité seront étudiés dans ce chapitre.
Lors de l'affinage des fromages de Munster, qui dure de 3 à 6 semaines selon le diamètre du fromage, la température est maintenue constante (15C) et le pH au niveau de la croûte (c'est à dire là où devra se développer la bactérie productrice de bactériocine pour agir contre L. monocytogenes) est généralement légèrement inférieur à 5 en début d'affinage ; en fin d'affinage, il se situe le plus souvent autour de 7, mais dans certains cas, selon les conditions de fabrication, des valeurs plus faibles, ou légèrement plus élevées, peuvent être obtenues. Lors du stockage ensuite, la température est maintenue à +4C et le pH de la croûte n'évolue plus. La période d'apparition de L. monocytogenes dans la croûte du fromage au cours de l'affinage est assez variable, cependant, cette bactérie n'a jamais été mise en évidence avant 7 j d'affinage.
Il est donc important, d'une part de pouvoir apprécier l'intensité de l'activité anti-Listeria des différentes souches étudiées et la rapidité d'apparition de cette activité dans les conditions de pH et de température effectivement rencontrées dans le fromage de Munster, d'autre part de connaître la stabilité des bactériocines produites dans ces mêmes conditions expérimentales. Les résultats obtenus devraient permettre d'éliminer, pour l'étude ultérieure dans le fromage, les souches produisant des bactériocines instables, peu actives ou en quantités insuffisantes dans les conditions d'affinage et de prévoir, pour les souches retenues, la période de l'affinage au cours de laquelle devra de préférence s'effectuer leur ensemencement dans le fromage.
Normalement, toutes les expériences réalisées dans ce chapitre en milieu de culture, auraient dû l'être dans les conditions de température effectivement rencontrées lors de l'affinage des fromages (c'est à dire à 15C). Cependant, lorsque l'étude réalisée n'est que comparative (influence de la présence de L. monocytogenes dans le milieu de culture sur le développement d'une activité anti-Listeria par la souche productrice de bactériocine, effet du pH sur la production des bactériocines, effet du pH sur l'activité anti-Listeria des bactériocines), une température de 37C, correspondant généralement à la température optimale de développement de la souche bactériocinogène et de production de bactériocine, est choisie afin de ne pas rendre excessive la durée des expériences entreprises, mais aussi d'augmenter l'amplitude des mesures d'activité effectuées et ainsi de permettre une meilleure comparaison des différentes souches bactériennes.
Matériel et méthodes
I. Souches bactériennes
(voir tableau IX, p. 41)II. Mesure du pH
Toutes les mesures de pH sont effectuées à l'aide d'un pH-mètre de type Schott CG-837.
III. Conditions de culture pour la production de bactériocines
Toutes les études portant sur la cinétique de croissance des souches sélectionnées et sur la production parallèle de bactériocines sont effectuées en bouillon MRS, à pH non régulé avec incubation à 15C ou à 37C, ou à pH régulé (5, 6 et 7) avec incubation à 37C
3 . Dans les études à pH régulé, un fermenteur de 2l (Chemap AG), avec une unité (CBC 5) de contrôle de la température (37C), du pH (par addition de soude 1M), de la mousse (par addition d'huile de silicone (Merck) à 10%) et de la vitesse d'agitation (500 t.min-1) est utilisé. La fermentation se fait sans introduction d'air ou d'oxygène.Les conditions d'inoculation sont identiques pour toutes les études portant sur la production des bactériocines. Elle est réalisée en ajoutant au bouillon MRS une culture de la souche test en fin de phase exponentielle (18 h à 37C dans un bouillon MRS) au 1/106 de façon à obtenir une concentration de 102 à 103 UFC/ml dans l'inoculum.
Après différents temps d'incubation, le pH de la culture (pour les cultures à pH non régulé), la concentration (UFC/ml) de la souche test (par dénombrement sur gélose MRS après 48 h d'incubation à 30C ou 37C) et la production de bactériocine (par mesure du diamètre de zone d'inhibition (voir p. 43)) sont déterminés.
IV. Croissance de L. monocytogenes en présence de la bactérie productrice de bactériocine
L. monocytogenes et la bactérie productrice de bactériocine sont ensemencées dans un bouillon MRS dont le pH est maintenu à 6. Les conditions d'inoculation de la bactérie indicatrice sont identiques à celles de la bactérie test (voir ci dessus § III). La croissance de L. monocytogenes est suivie par dénombrement sur une gélose Oxford avec une incubation de 48 h à 37C et recours à l'enrichissement pour les faibles concentrations (voir p. 8). La concentration en bactéries tests est obtenue en soustrayant de la concentration bactérienne totale, déterminée par un dénombrement sur gélose TSLA (incubation de 18 à 24 h à 37C), la concentration de L. monocytogenes déterminée précédemment.
V. Influence du pH sur l'activité des bactériocines
L'extrait de culture contenant la bactériocine (voir p. 43) est ajusté à pH 4, 5, 6, 7 ou 8 avant d'être ensemencé d'une culture de L. monocytogenes 4d (18 h à 37C dans un bouillon MRS) diluée au 1/10 de façon à obtenir une concentration de bactéries comprise entre 107 et 108 UFC/ml. La suspension est incubée à 37C pendant 2, 4 ou 18 h suivant les bactéries productrices. Le taux de réduction de L. monocytogenes aux différents pH est obtenu en comparant sa concentration initiale à la concentration restant après incubation en présence de la bactériocine. Le dénombrement de la bactérie est effectué sur gélose TSLA avec une incubation à 37C pendant 18 à 24 h.
VI. Influence de la température et du pH sur la stabilité des bactériocines
L'extrait de culture contenant la bactériocine est ajusté à pH 5, 6, 7 ou 8, puis stocké à 15C. Dans une série parallèle, l'extrait de culture est préalablement traité à 100C pendant 10 min avant d'être stocké à 15C. La stabilité de la bactériocine est suivie par la détermination de l'activité antibactérienne (UA/ml) (voir p. 43) tout au long du stockage.
Par ailleurs, l'extrait de culture contenant la bactériocine est soumis pendant 15 min à différentes températures : 25C, 50C, 75C, 100C ou 121C. La proportion de bactériocine détruite par le traitement thermique correspond à la différence entre les activités antibactériennes initiale et résiduelle (UA/ml).
Résultats et discussion
I. Comportement de L. monocytogenes en présence de la souche bactériocinogène dans un bouillon de culture
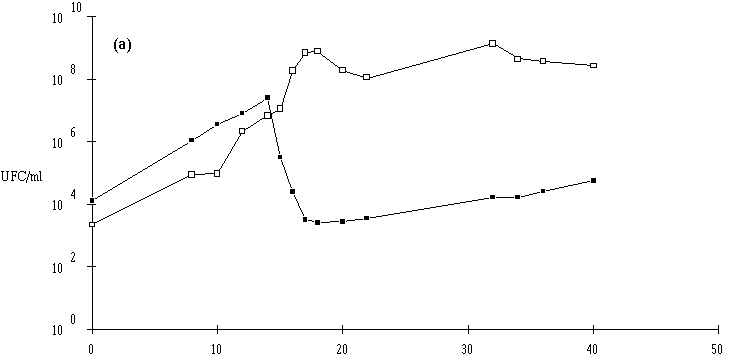
Des inoculums des différentes souches bactériocinogènes sont, chacun séparément, mis en présence d'une concentration sensiblement égale de L. monocytogenes 4d (les inoculums de la souche test et de la souche indicatrice variant entre 6,0.102 UFC/ml et 1,0.104 UFC/ml) dans un bouillon de culture MRS à pH régulé à 6. L'évolution de la concentration de la bactérie bactériocinogène et celle de la concentration de L. monocytogenes sont suivies au cours du temps d'incubation (figures 24a, 25a, 26a et 27a, b, c).
Des expériences parallèles sont réalisées en substituant aux souches tests bactériocinogènes des souches tests non bactériocinogènes (Lb. brevis CIP 102806T, E. faecium 25, E. faecalis LIR 38 et Lc. lactis M3) (figures 24b, 25b, 26b et 27d). Lorsque L. monocytogenes est incubée en présence de telles souches, sa croissance est tout à fait normale, avec une phase exponentielle qui dure 18 h et une phase stationnaire au cours de laquelle sa concentration se stabilise généralement aux environs de 108 UFC/ml, et n'est pas perturbée par la très bonne croissance des bactéries tests qui atteignent le plus souvent une concentration d'environ 109 UFC/ml à la fin de leur phase exponentielle de croissance.
En présence des souches productrices de bactériocines, et au cours de leur phase exponentielle de croissance, un effet sur la croissance de L. monocytogenes est toujours observé. Cet effet se traduit par une baisse de la concentration en L. monocytogenes, sauf en présence d'E. faecalis 96 où une simple stabilisation de la concentration de L. monocytogenes est notée (figure 26a). L'effet bactériostatique noté est en bon accord avec les observations faites lors de l'étude du mode d'action de l'entérocine 96 à pH 6 (voir p. 64).
L'effet anti-Listeria observé est donc bien imputable à la production des bactériocines par les souches tests. Ces résultats confirment par ailleurs ceux obtenus dans le chapitre précédent, à savoir le caractère bactéricide des bactériocines produites par 5 des souches (Lb. brevis DSM 9296, E. faecium 81, Lc. lactis 102, 99 et 53) et le caractère bactériostatique, à pH 6, de la bactériocine produite par E. faecalis 96.

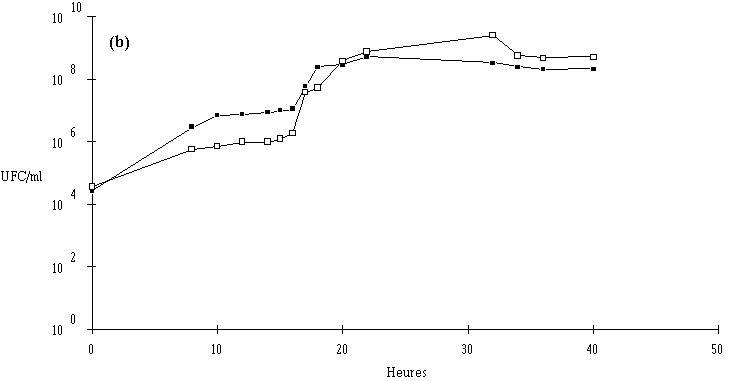
Figure 24
: Comportement de L. monocytogenes (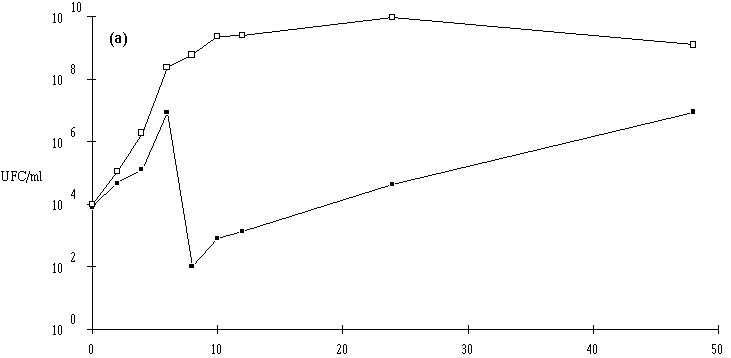
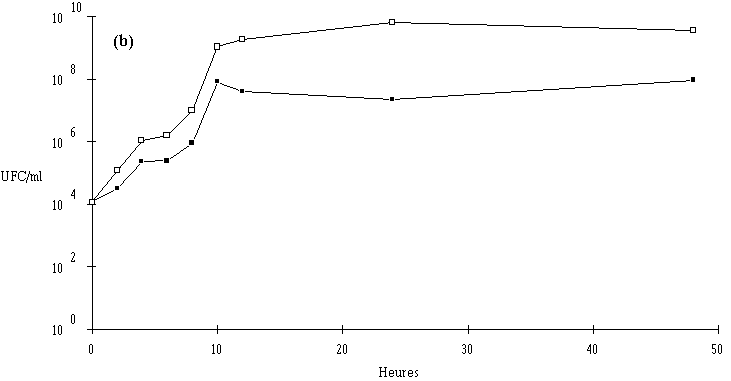
Figure 25
: Comportement de L. monocytogenes (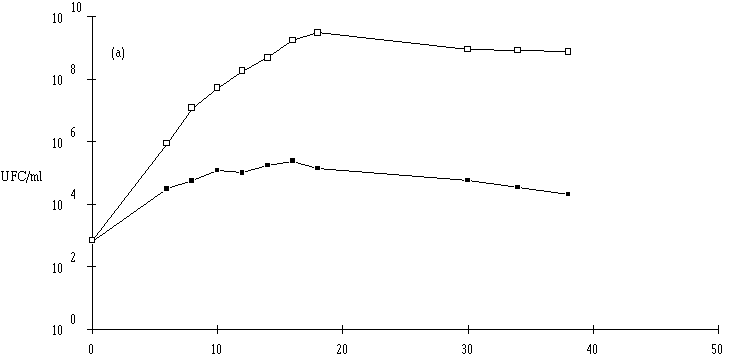
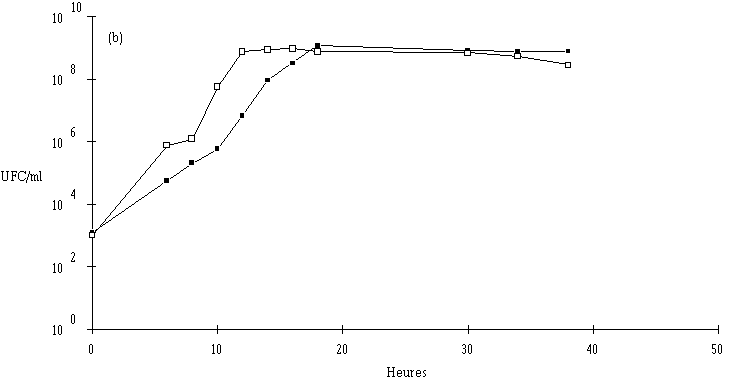
Figure 26
: Comportement de L. monocytogenes (L'apparition de l'effet anti-Listeria est constatée à partir d'une concentration minimale de bactéries productrices qui varie de 106-107 UFC/ml dans le cas de Lb. brevis DSM 9296 à 108 UFC/ml dans le cas de Lc. lactis 102. Elle se situe, suivant le taux de croissance de ces bactéries, entre 8 h (E. faecium 81) et 16 h d'incubation (Lc. lactis 53). La concentration de bactéries productrices nécessaire pour produire un effet bactéricide détectable varie en effet en fonction de l'importance de la production de bactériocine et/ou de l'activité de la bactériocine (voir § II.2, p. 90).
Lorsqu'un effet bactéricide est observé, il est d'importance inégale suivant les souches (réduction de 4, 3 et 2 unités logarithmiques d'une population de L. monocytogenes d'environ 107 UFC/ml, respectivement en présence d'E. faecium 81, de Lb. brevis DSM 9296 et de Lc. lactis 53). La durée d'action est également variable (2 h pour E. faecium 81, 3 h pour Lb. brevis DSM 9296 et 6 h pour Lc. lactis 53). En ce qui concerne Lc. lactis 102 et 99, l'effet anti-Listeria paraît important, mais un développement anormalement lent de L. monocytogenes durant les premières heures d'incubation (imputable vraisemblablement à une erreur de manipulation (état physiologique de l'inoculum)) ne permet pas de l'apprécier correctement.
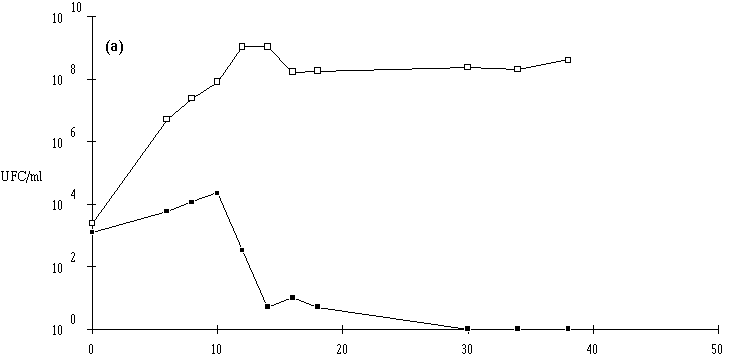
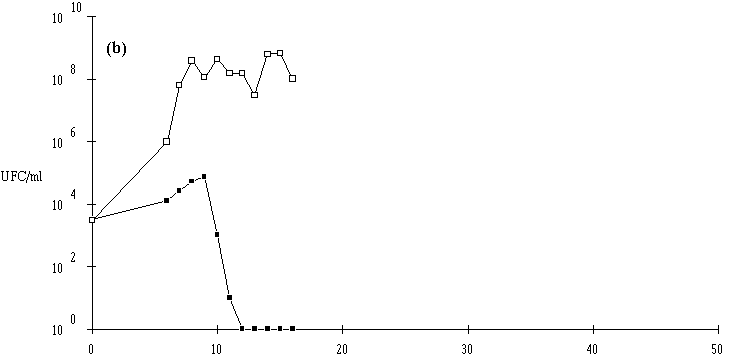
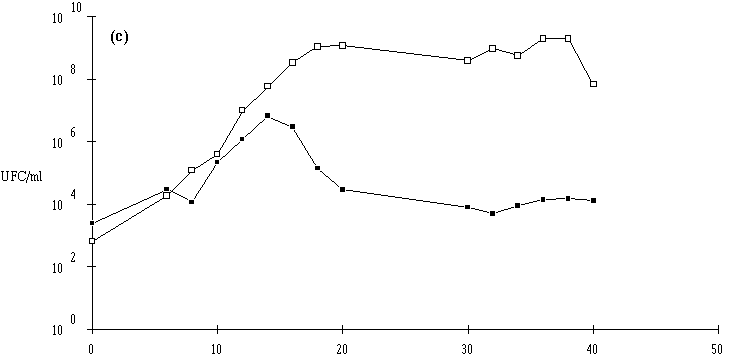
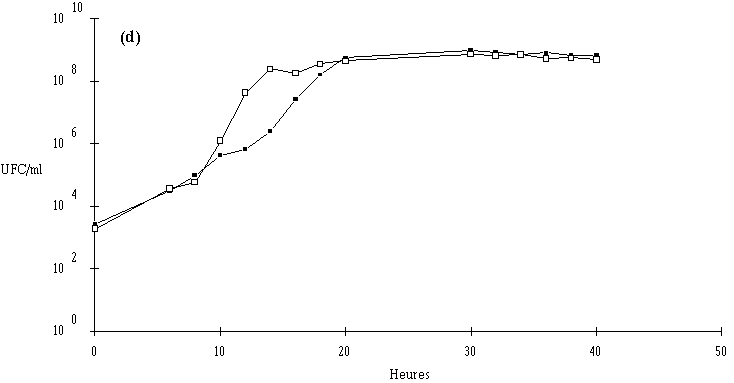
Figure 27
: Comportement de L. monocytogenes (Dans les cas où L. monocytogenes s'est développée normalement, pour atteindre des concentrations approchant 107 UFC/ml (6,7.106 UFC/ml avec Lb. brevis DSM 9296, 8,4.106 UFC/ml avec E. faecium 81 et 6,6.106 UFC/ml avec Lc. lactis 53) avant que ne soit constaté l'effet bactéricide, la concentration de L. monocytogenes ne s'annule pas après cet effet. De ce fait, une reprise de croissance de cette dernière est observée en prolongeant l'incubation. Cette croissance est cependant très lente, sans doute parce que la plupart des cellules bactériennes revivifiables présentent des lésions qui ralentissent leur multiplication (Bhunia et al., 1991).
Une conséquence importante de ces résultats est qu'il ne faut pas attendre que la concentration en L. monocytogenes soit trop élevée pour faire agir la bactériocine, si une absence totale est exigée dans le bouillon de culture. En ce qui concerne l'éventuelle utilisation des souches bactériocinogènes pour l'élimination de L. monocytogenes dans les fromages de Munster, il apparaît donc très souhaitable de procéder à l'ensemencement de la souche bactériocinogène avant que n'apparaisse L. monocytogenes, donc en tout début d'affinage. Il est même préférable que la souche test ait achevé sa production de bactériocine avant cette apparition.
II. Effet du pH et de la température sur la vitesse de production, la quantité et
l'activité des bactériocines produites par les différentes souches tests
1. Période de production des différentes bactériocines au cours de l'incubation des
souches tests en bouillon de culture
La température d'incubation est de 15C (température d'affinage du fromage de Munster) et le pH du milieu de culture, initialement de 6,2, n'est pas régulé. Les résultats obtenus concernant le développement des différentes souches tests, la vitesse et l'importance de la production de bactériocines (exprimée par le diamètre de la zone d'inhibition sur gélose) et l'évolution du pH du milieu en fonction de la durée d'incubation sont donnés dans les figures 28 à 33.

Figure 28
: Cinétique de croissance de Lb. brevis DSM 9296 et de production de bactériocine dans un bouillon MRS à 15C et à pH non contrôlé. UFC/ml (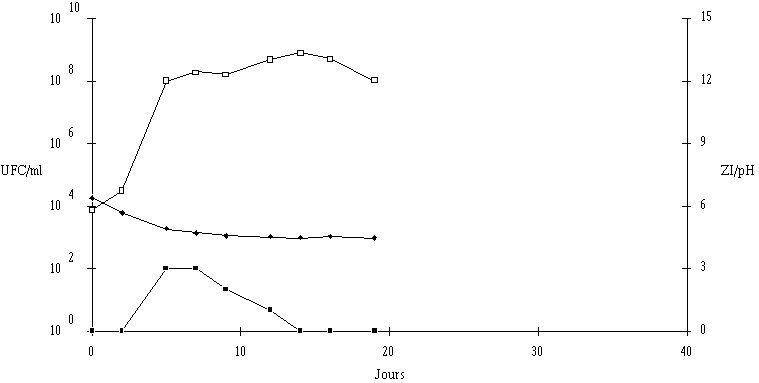
Figure 29
: Cinétique de croissance d'E. faecium 81 et de production de bactériocine dans un bouillon MRS à 15C et à pH non contrôlé. UFC/ml (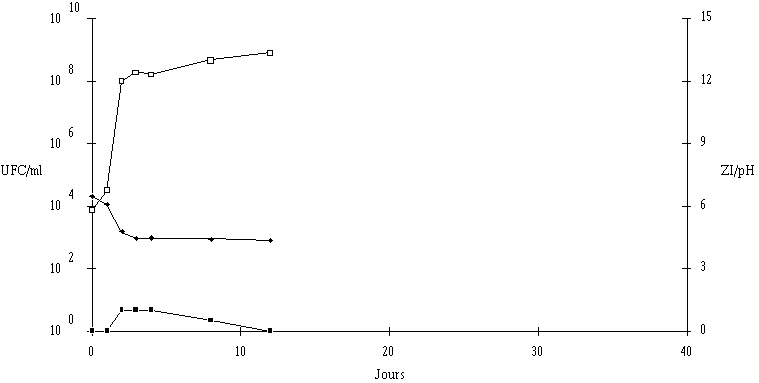
Figure 30
: Cinétique de croissance d'E. faecalis 96 et de production de bactériocine dans un bouillon MRS à 15C et à pH non contrôlé. UFC/ml (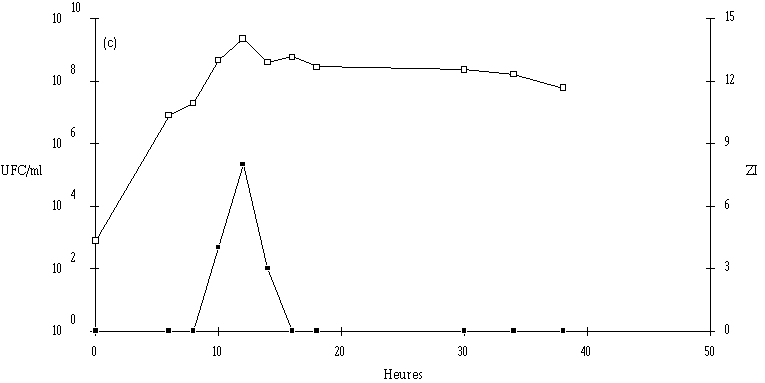
Figure 31
: Cinétique de croissance de Lc. lactis 102 et de production de bactériocine dans un bouillon MRS à 15C et à pH non contrôlé. UFC/ml (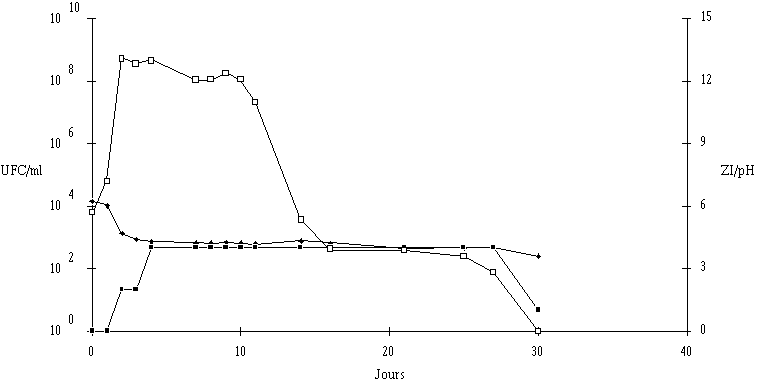
Figure 32
: Cinétique de croissance de Lc. lactis 99 et de production de bactériocine dans un bouillon MRS à 15C et à pH non contrôlé. UFC/ml (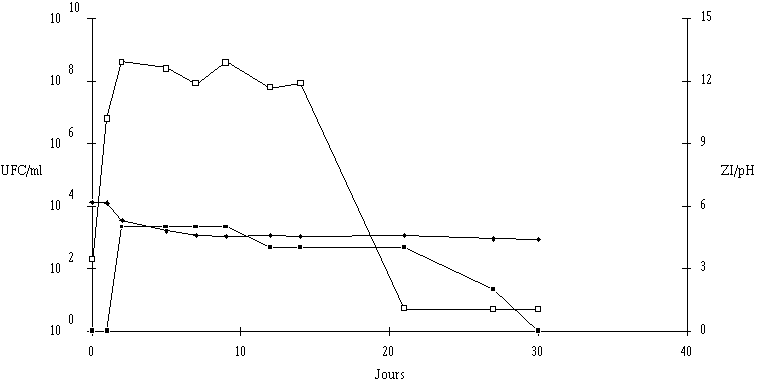
Figure 33
: Cinétique de croissance de Lc. lactis 53 et de production de bactériocine dans un bouillon MRS à 15C et à pH non régulé. UFC/ml (Au terme de leur phase exponentielle de croissance, les souches tests sont à des concentrations comprises entre 108 et 109 UFC/ml. Leur développement satisfaisant entraîne une baisse du pH du milieu de culture, celui-ci étant toujours de l'ordre de 4 en fin de la phase exponentielle de croissance. La durée de cette phase exponentielle est courte (2 j) pour 4 des souches tests (E. faecalis 96, Lc. lactis 102, 99 et 53) et un peu plus longue (5 j) pour Lb. brevis DSM 9296 et E. faecium 81. Les quantités de bactériocines produites, appréciées grossièrement par la mesure des diamètres des zones d'inhibition, apparaissent maximales pour toutes les souches tests en fin de phase exponentielle. Au cours de la phase stationnaire de croissance, la quantité de bactériocine reste stable (cas de la brévicine 9296) ou décroît plus ou moins rapidement (cas des bactériocines produites par les autres souches tests).
Dans tous les cas, il apparaît clairement que la bactériocine est produite durant la phase exponentielle de croissance de la souche test, ce qui permet de comprendre pourquoi une reprise de la croissance de L. monocytogenes est observée durant la phase stationnaire de la souche test dans une culture mixte (voir § I, p. 82). Il s'agit d'un résultat (production des bactériocines en tant que métabolites primaires) qui semble être une caractéristique générale des souches bactériocinogènes (Nettles et Barefoot, 1993). Cette observation a été mentionnée pour les lactobacilles par Barefoot et Klaenhammer (1984), Schillinger et Lüke (1989), Toba et al. (1991), Benoît et al. (1994), Enan et al. (1994) et Kawai et al. (1994), pour les entérocoques par Parente et Hill (1992a) et pour les lactocoques par Geis et al. (1983), Kojic (1991), De Vuyst et Vandamme (1992, 1993) et Parente et al. (1994).
Il apparaît aussi, et cela est important en vue de l'application ultérieure des souches tests à l'élimination de L. monocytogenes dans les fromages de Munster, que l'ensemble de ces souches produisent la totalité de leurs bactériocines assez rapidement, en tout cas en moins de 7 j, donc avant l'apparition de L. monocytogenes dans les fromages. La vitesse de production des bactériocines est donc dans tous les cas satisfaisante. Toutefois, étant donné que les évolutions du pH dans le bouillon MRS et du pH dans le fromage de Munster en début d'affinage ne sont pas identiques, la confirmation de ces résultats devra être apportée par des études réalisées sur l'aliment.
2. Etude de la quantité de bactériocines produite par les différentes souches tests en fonction du pH et de la température du milieu de culture.
L'appréciation de la quantité de bactériocine produite, réalisée par une mesure du diamètre de zone d'inhibition, est en fait une mesure de l'activité anti-Listeria de l'extrait de culture dans des conditions de pH constant (l'extrait de culture est toujours ajusté à pH 6 et la double couche de gélose est constituée des milieux MRS (pH 6,2) et LA (pH 6,8)). Une telle mesure ne permet donc pas de comparer les quantités produites par des souches tests différentes dans les mêmes conditions expérimentales (pH et température), dans la mesure où les différentes bactériocines n'ont pas forcément la même activité anti-Listeria dans des conditions de pH et de température données. Cependant, elle permet, pour une même souche test, de comparer les quantités de bactériocine produites à différentes températures ou à différents pH.
2.1. Importance de la production à 15 C par rapport à la production à 37C
Les résultats obtenus concernant le développement des souches tests et la production de bactériocines en bouillon de culture à 37C et à pH non contrôlé sont donnés dans les figures 34 à 39 et sont à comparer avec ceux obtenus pour les mêmes souches tests à 15C (figures 28 à 33).
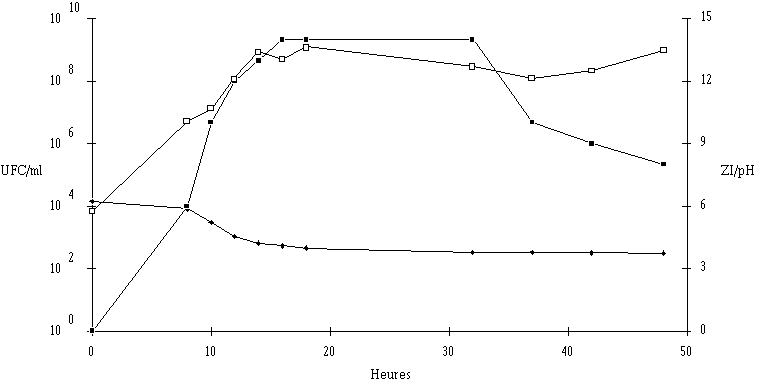
Figure 34
: Cinétique de croissance de Lb. brevis DSM 9296 et de production de bactériocine dans un bouillon MRS à 37C et à pH non contrôlé. UFC/ml (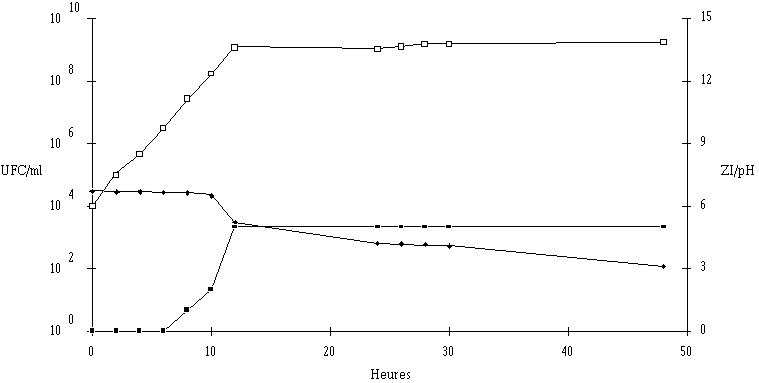
Figure 35
: Cinétique de croissance d'E. faecium 81 et de production de bactériocine dans un bouillon MRS à 37C et à pH non contrôlé. UFC/ml (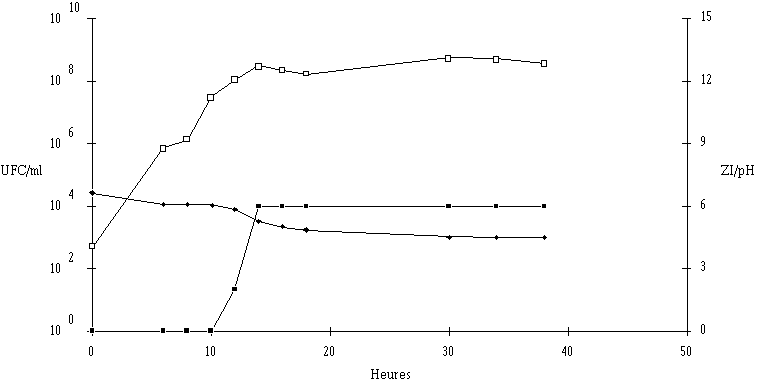
Figure 36
: Cinétique de croissance d'E. faecalis 96 et de production de bactériocine dans un bouillon MRS à 37C et à pH non contrôlé. UFC/ml (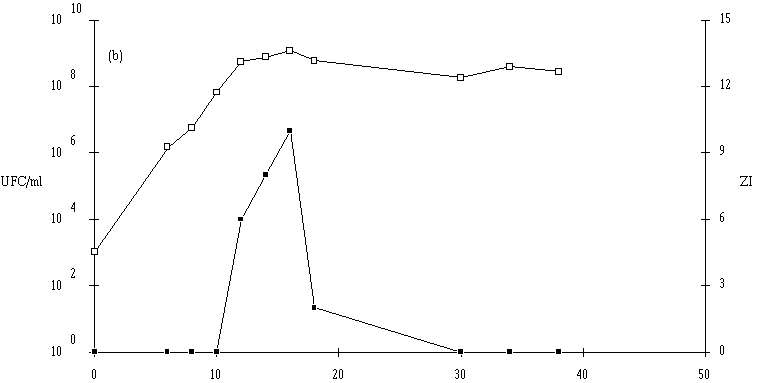
Figure 37
: Cinétique de croissance de Lc. lactis 102 et de production de bactériocine dans un bouillon MRS à 37C et à pH non contrôlé. UFC/ml (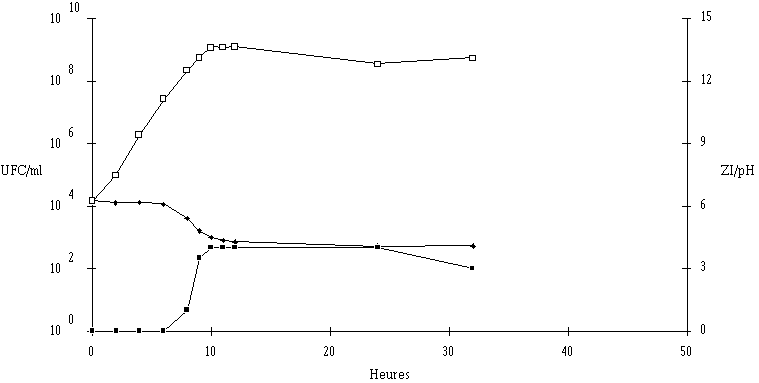
Figure 38
: Cinétique de croissance de Lc. lactis 99 et de production de bactériocine dans un bouillon MRS à 37C et à pH non contrôlé. UFC/ml (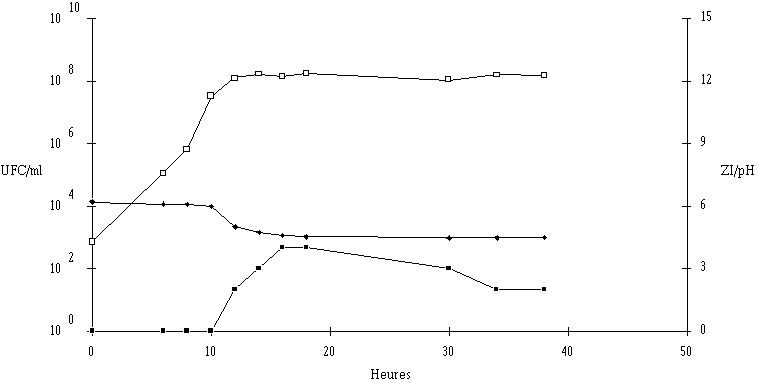
Figure 39
: Cinétique de croissance de Lc. lactis 53 et de production de bactériocine dans un bouillon MRS à 37C et à pH non régulé. UFC/ml (Une augmentation de la température d'incubation n'a apparemment aucun effet sur la concentration des souches tests en fin de phase exponentielle (toujours comprise entre 108 et 109 UFC/ml), ni sur l'évolution du pH du milieu de culture au cours de cette phase (celui-ci diminue environ de 6,2 à 4). Les résultats obtenus permettent également de montrer, de façon encore plus nette que lors d'une incubation réalisée à 15C, que la production de bactériocine n'est effective que durant la phase exponentielle de croissance de la souche test. Fort logiquement, l'élévation de la température diminue la durée de la phase exponentielle de croissance des souches tests, cette durée restant sensiblement la même (de 10 à 14 h) pour toutes les souches. L'élévation de la température a également une influence sur la quantité de bactériocine produite, mais les effets obtenus ne sont pas identiques pour toutes les souches (tableau XIV). Pour quatre de ces souches (E. faecalis 96, Lc. Lactis 102, E. faecium 81 et Lb. brevis DSM 9296), une augmentation de la quantité de bactériocine produite en fin de phase exponentielle est observée. De tels résultats peu surprenants ont déjà été mentionnés pour de nombreuses autres souches bactériocinogènes (Lewus et Montville, 1992 ; Uhlman et al., 1992 ; Enan et al., 1994) et peuvent s'expliquer de plusieurs façons.
En effet, l'élévation de la température d'incubation entraîne très normalement une augmentation du taux de croissance de la bactérie productrice. Or, selon Hastings et Stiles (1991) et Geisen et al. (1993), plus ce taux de croissance est élevé, plus la quantité de bactériocine produite est importante. Par ailleurs, il est vraisemblable que le passage de 15C à 37C de la température d'incubation a pour conséquence de rendre plus efficaces certaines enzymes participant aux processus de synthèse des bactériocines (Biswas et al., 1991, De Vuyst et Vandamme, 1992). Enfin, selon ces mêmes auteurs, cette élévation de température, en permettant d'augmenter la densité cellulaire dans le milieu de culture, devrait également concourir à l'augmentation de la production de bactériocines. Cette dernière raison ne peut être avancée dans la présente étude puisque la densité bactérienne en fin de phase exponentielle de croissance est du même ordre de grandeur après incubation à 15C et à 37C. Il sera cependant montré ultérieurement qu'un faible développement de la bactérie productrice peut effectivement se traduire par une baisse de la production de bactériocine, ce qui est tout à fait normal.
Tableau XIV
: Estimation de la quantité de bactériocine produite dans un bouillon de culture à pH non régulé (diamètres des zones d'inhibition en mm) en fin de phase exponentielle de croissance d'une souche test en fonction de la température d'incubation
Les résultats obtenus avec Lc. lactis 99 et 53, stabilité ou diminution de la quantité de bactériocine produite, paraissent plus surprenants, mais des résultats analogues ont déjà été mentionnés lors de l'étude d'autres souches bactériocinogènes (Schillinger et Lüke, 1989 ; Lewus et Montville, 1992 ; Geisen et al., 1993). Aucune explication à de telles observations n'a cependant été fournie par ces auteurs.
2.2. Effet du pH sur la production de bactériocine
Dans la mesure où la température lors de l'affinage des fromages de Munster est toujours de l'ordre de 15C, les résultats obtenus précédemment n'ont pas de conséquences particulières concernant l'effet anti-Listeria des souches tests dans ces fromages. L'effet du pH du milieu de culture (à température constante) sur la quantité de bactériocine produite est par contre beaucoup plus intéressant à étudier dans cette optique. En effet, le pH au niveau de la croûte du fromage de Munster est en général légèrement inférieur à 5 dans le fromage à l'état de blanc et se trouve généralement compris entre 5 et 6 à la fin de la première semaine d'affinage, période durant laquelle la souche test devra croître et produire sa bactériocine. Il est donc important de comparer les quantités de bactériocines produites par les bactéries tests à différents pH régulés (spécialement à pH 5 et à pH 6) afin de pouvoir sélectionner celles dont la production serait satisfaisante a priori dans les conditions de pH du début de la période d'affinage des fromages de Munster.
La quantité de bactériocine produite peut en effet dépendre du pH du milieu. Les explications justifiant cette dépendance sont les mêmes que celles déjà données à propos de l'influence de la température sur la production de bactériocine. En effet, selon Hastings et Stiles (1991) et Geisen et al. (1993), la quantité de bactériocine produite par une bactérie est d'autant plus réduite que le taux de croissance de celle-ci est faible. Or, un changement de pH du milieu peut modifier ce taux de croissance. Il peut également entraîner une diminution de la concentration de la souche test atteinte en fin de phase exponentielle de croissance et de ce fait limiter ou rendre non détectable la formation de bactériocine (Biswas et al., 1991 ; De Vuyst et Vandamme, 1992). Selon ces mêmes auteurs, l'influence du pH sur la production des bactériocines peut également être due à un effet sur les processus de synthèse : inactivation partielle ou totale de certaines réactions enzymatiques par exemple.
Les résultats de l'étude entreprise sont présentés dans les figures 40 à 45. Celles-ci indiquent l'évolution de la concentration en souches tests (UFC/ml) et de la quantité de bactériocines formées (diamètres des zones d'inhibition) au cours d'une incubation dans un bouillon de culture à 37C et à pH régulés (5, 6 et 7). Dans le tableau XV sont reprises les valeurs des diamètres des zones d'inhibition reflétant l'activité bactéricide des extraits de culture des souches tests en fin de la phase exponentielle de croissance.
En ce qui concerne Lb. brevis DSM 9296, le pH du milieu de culture ne semble pas avoir d'influence sur la concentration de bactéries en fin de la phase exponentielle de croissance, qui est toujours comprise entre 108 et 109 UFC/ml. Cependant, la croissance à pH 7 est plus lente que celle observée aux autres pH : une phase de latence de 8 h est constatée (figure 40c).
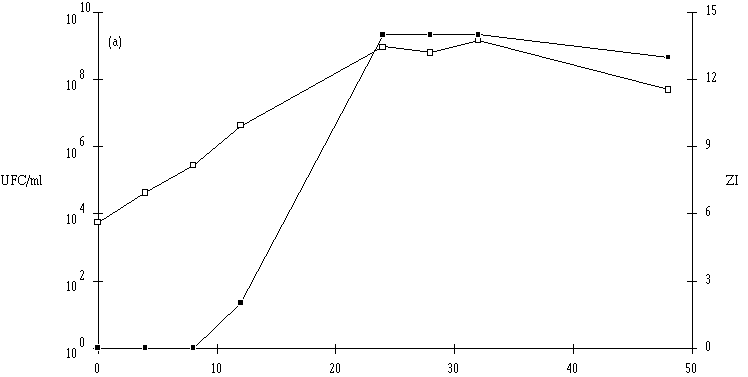
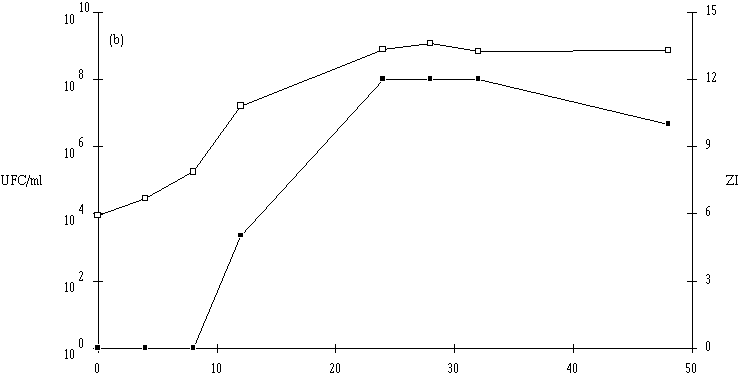
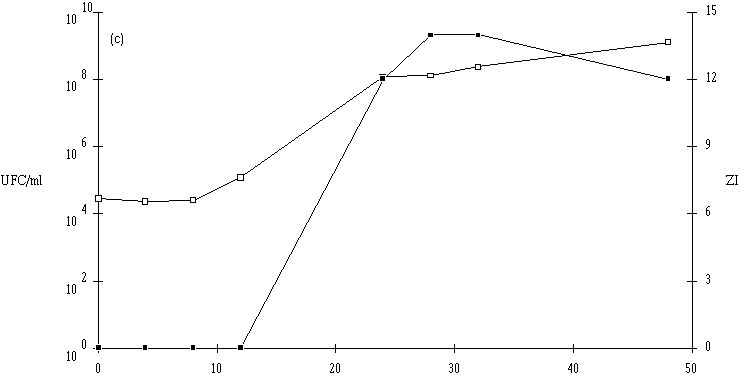
Figure 40
: Cinétique de croissance de Lb. brevis DSM 9296 et de production de bactériocine dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (L'apparition d'un effet anti-Listeria dans l'extrait de culture correspond dans tous les cas à une concentration de Lb. brevis DSM 9296 de l'ordre de 106 UFC/ml dans le milieu de culture. Elle est donc fort logiquement retardée à pH 7.
La quantité de brévicine 9296 produite ne semble pas dépendre du pH de la culture (tableau XV) et le ralentissement du taux de croissance de Lb. brevis DSM 9296, observé à pH 7, n'a apparemment pas d'influence notable sur cette quantité.
Généralement, la production des bactériocines par les lactobacilles, optimale autour de pH 5, décroît rapidement en s'éloignant de cette valeur (Joerger et Klaenhammer, 1986 ; Vaughan et al., 1992 ; Jimenez-Diaz et al., 1993 ; Yang et Ray, 1994). Lb. brevis DSM 9296 est donc une souche intéressante dans la mesure où la quantité de bactériocine produite n'est pas dépendante du pH du milieu, du moins pour des valeurs comprises entre 5 et 7.
Tableau XV
: Estimation de la quantité de bactériocine produite (diamètres des zones d'inhibition en mm) en fin de phase exponentielle de croissance d'une souche test en fonction du pH dans un bouillon MRS à 37C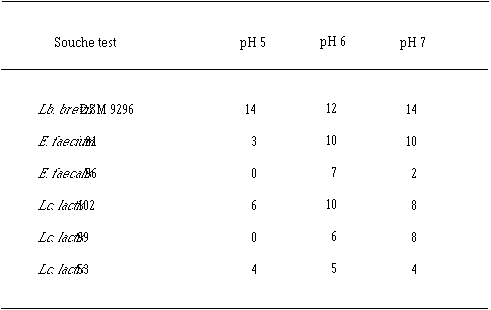
Le taux de croissance d'E. faecium 81 est assez nettement plus faible à pH 5 qu'à pH 6 et 7 (figure 41). Par contre, la concentration de la souche test atteinte à la fin de la phase exponentielle de croissance (![]() 109 UFC/ml) ne semble pas dépendre du pH du milieu de culture.
109 UFC/ml) ne semble pas dépendre du pH du milieu de culture.
L'apparition d'un effet anti-Listeria ne se manifeste qu'à des concentrations de bactéries productrices supérieures à 107 UFC/ml (à pH 6) et à 108 UFC/ml (à pH 5 et 7). La quantité de bactériocine mesurée en fin de phase exponentielle de croissance (tableau XV) est beaucoup plus faible à pH 5 qu'à pH 6 ou 7. Sans doute parce que la croissance de la bactérie y est moins rapide, mais ce n'est peut être pas la seule raison. Kato et al. (1993) ont déjà constaté une telle évolution de la production de bactériocine en fonction du pH (la production d'entérocine-100 par E. faecium-100, optimale à pH 6,3, s'annulant à pH 5).
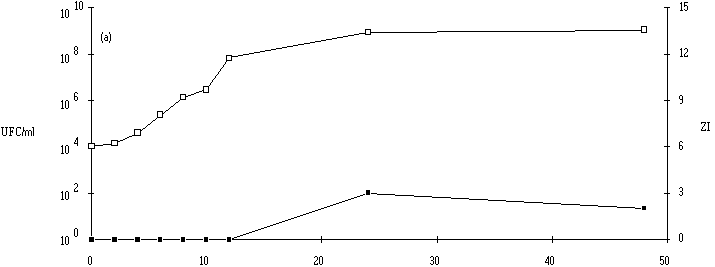
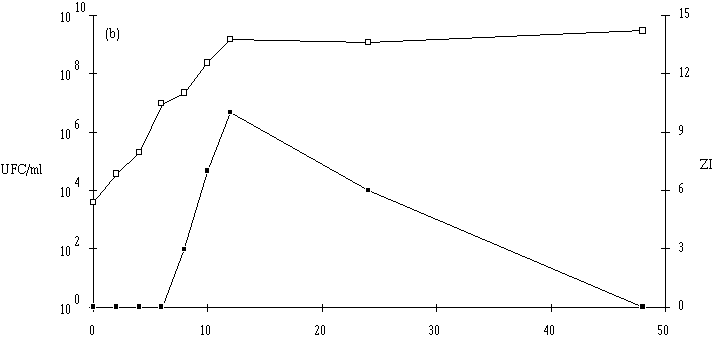
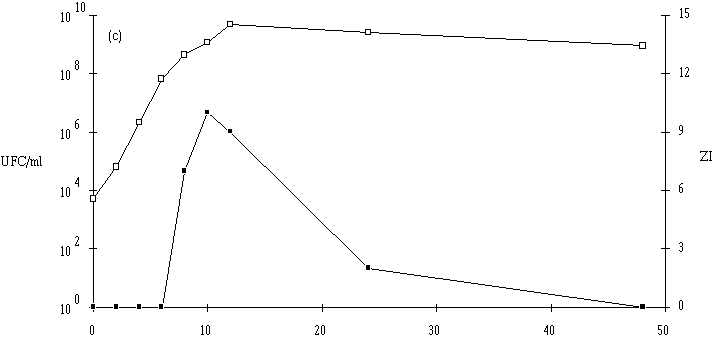
Figure 41
: Cinétique de croissance d'E. faecium 81 et de production de bactériocine dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (Le comportement de l'autre entérocoque, E. faecalis 96, est plus complexe. Tout d'abord, il apparaît que le taux de croissance de cette bactérie est plus faible à pH 7 qu'à pH 5 ou 6, puisque la durée de la phase exponentielle de croissance est de 18 h à pH 7, alors qu'elle n'est que de 8 h à pH 5 et 14 h à pH 6 (figure 42). Mais inversement, la concentration de souche test en fin de phase exponentielle de croissance est plus élevée à pH 7 (1010 UFC/ml) qu'à pH 5 (107 UFC/ml) et même qu'à pH 6 (109 UFC/ml). Ce n'est qu'à ce pH (taux de croissance élevé et quantité de bactéries importante) qu'une quantité appréciable d'entérocine 96 est obtenue en fin de phase exponentielle de croissance. L'effet anti-Listeria dans l'extrait de culture apparaît lorsque la concentration de bactéries productrices est supérieure ou égale à 108 UFC/ml. L'absence de production de bactériocine à pH 5 (figure 42a) est sans doute due à une concentration encore insuffisante de la souche test en fin de phase exponentielle de croissance (<107 UFC/ml). A pH 7, c'est vraisemblablement un taux de croissance faible de la bactérie productrice, mais probablement aussi une instabilité importante de la bactériocine à un tel pH qui expliqueraient la faible quantité de bactériocine retrouvée à la fin de la phase exponentielle de croissance (figure 42c).
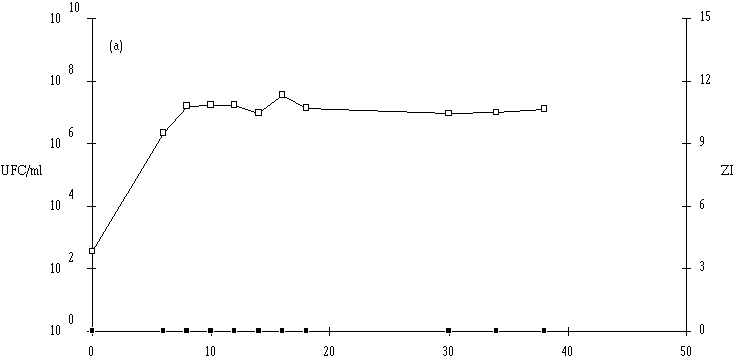
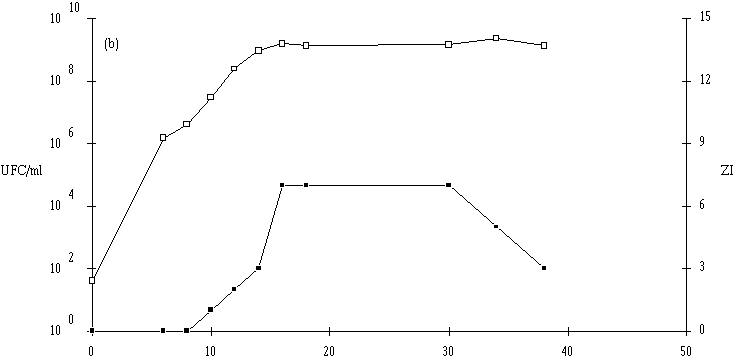
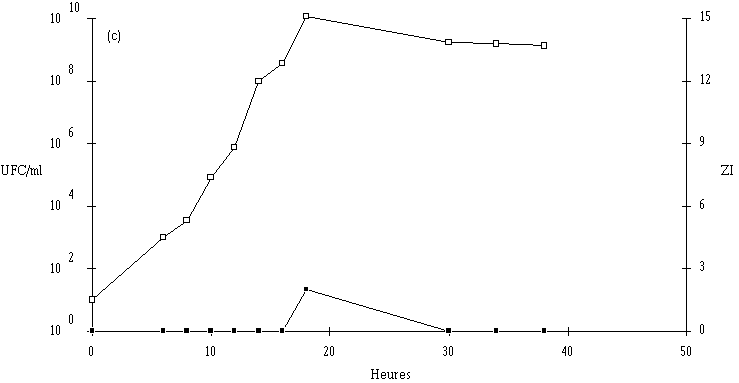
Figure 42
: Cinétique de croissance d'E. faecalis 96 et de production de bactériocine dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (Le taux de croissance de Lc. lactis 102 ne dépend pas du pH (durée de la phase exponentielle de croissance environ 12 h) et les concentrations en souches tests en fin de phase exponentielle sont toujours comprises entre 108 et 109 UFC/ml (figure 43). L'effet anti-Listeria apparaît pour des concentrations bactériennes supérieures à 107 UFC/ml, quel que soit le pH. A pH 5, la production de bactériocine est nettement diminuée par rapport à celle obtenue à pH 6 et même à pH 7 (tableau XV). Etant donné qu'aucun effet du pH sur la croissance de Lc. lactis 102 n'est observé, une action sur le processus de synthèse de la substance active peut être évoquée.
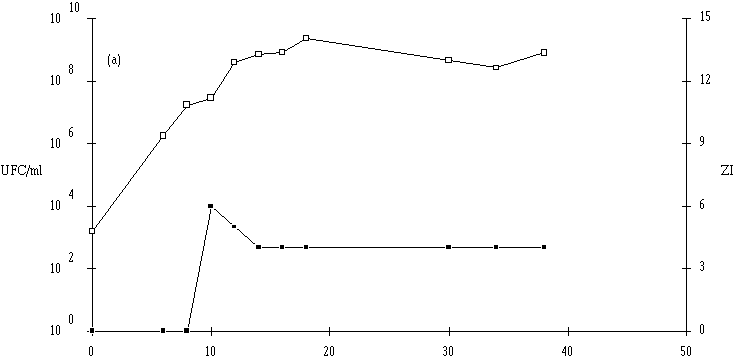
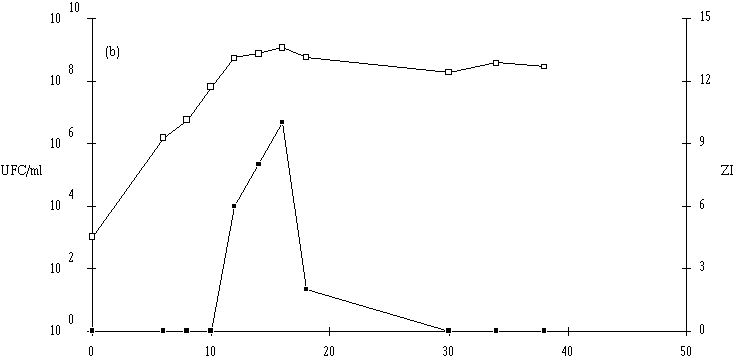
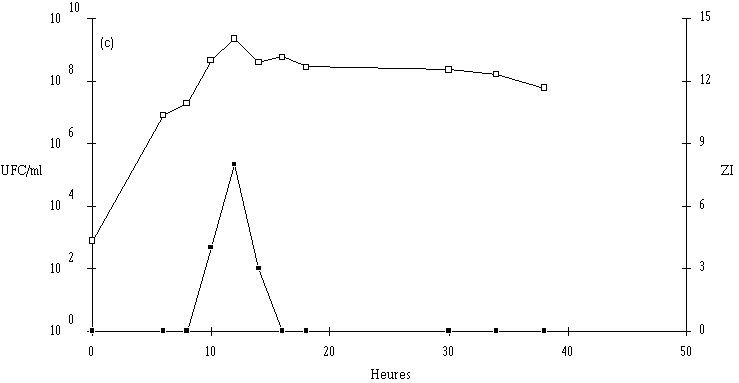
Figure 43
: Cinétique de croissance de Lc. lactis 102 et de production de bactériocine dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (En ce qui concerne Lc. lactis 99, le taux de croissance de cette bactérie est beaucoup plus faible à pH 5 qu'à pH 6 ou 7 (figure 44). Il en est de même pour la concentration bactérienne en fin de phase exponentielle qui n'est que de 3.105 UFC/ml à pH 5, alors que celle-ci est comprise entre 109 et 1010 UFC/ml à pH 6 et 7. A ces pH, l'effet anti-Listeria n'apparaît que très tardivement, lorsque la concentration de la souche test est supérieure à 108 UFC/ml). Il n'est donc guère surprenant qu'aucune production ne soit détectée à pH 5.
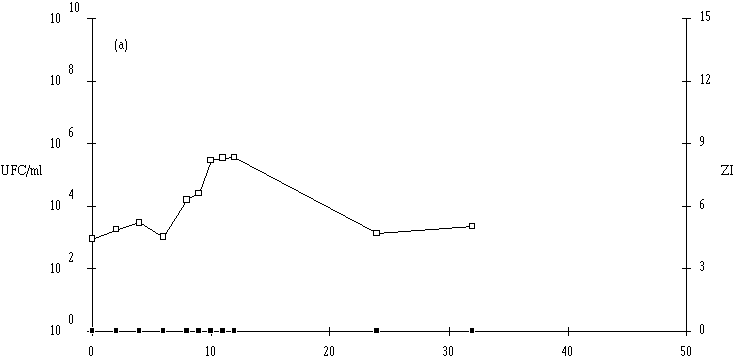
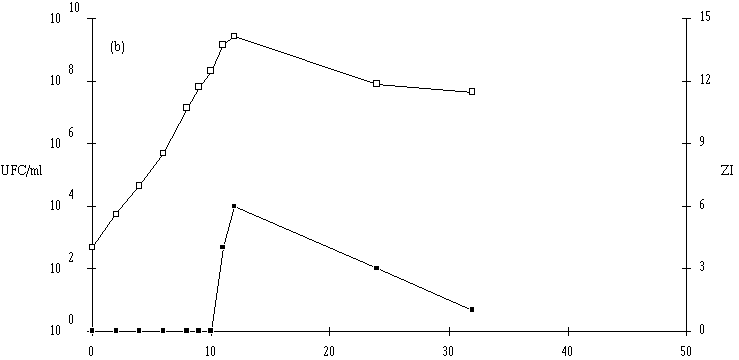
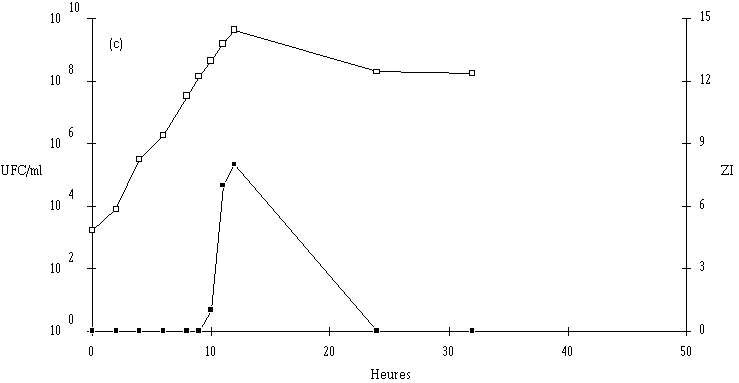
Figure 44
: Cinétique de croissance de Lc. lactis 99 et de production de bactériocine par dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (La production de lactococcine 99 semble donc favorisée aux pH proches de la neutralité (tableau XV). Une telle constatation a été faite dans le cas de la lactococcine 102.
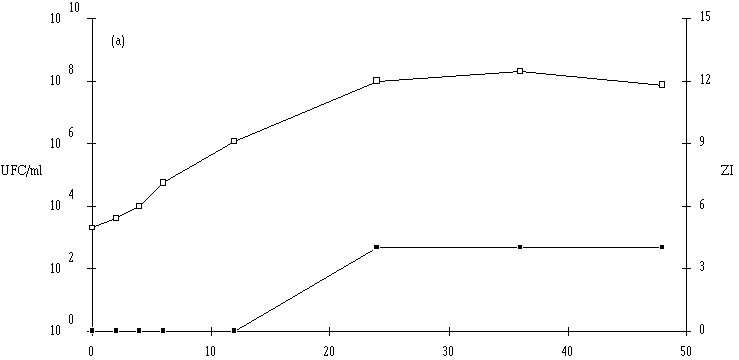
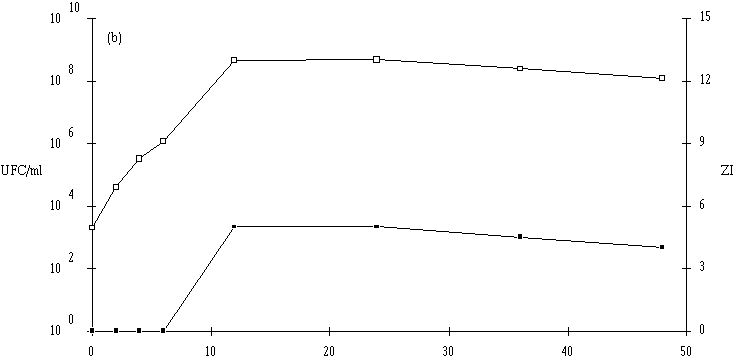
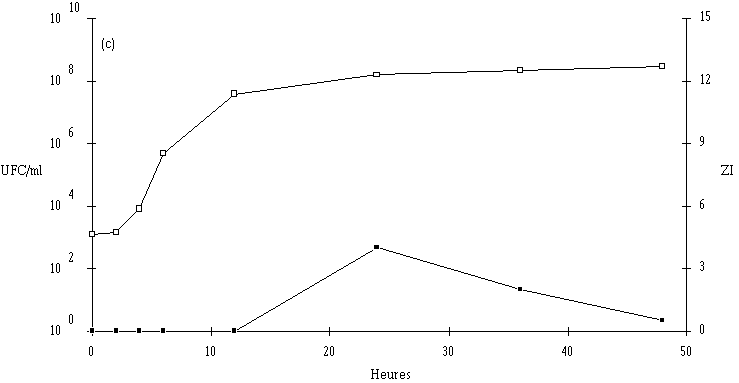
Figure 45
: Cinétique de croissance de Lc. lactis 53 et de production de bactériocine par dans un bouillon MRS à 37C. (a) pH 5, (b) pH 6, (c) pH 7. (Le taux de développement de Lc. lactis 53 est nettement plus faible à pH 5 qu'à pH 6 ou 7 (figure 45), mais quel que soit le pH, la concentration en souche test à la fin de la phase exponentielle de croissance est de l'ordre de 108 UFC/ml. La production de bactériocine n'est mesurée que pour des concentrations de Lc. lactis 53 (en fin de phase exponentielle de croissance) supérieures à 106 UFC/ml à pH 5 et 6 et supérieures à 107 UFC/ml à pH 7. Apparemment, le ralentissement de la vitesse de croissance de la souche test à pH 5 n'a pas eu de conséquences sur la quantité de bactériocine produite, qui ne semble pas dépendre du pH.
Le comportement des trois lactocoques (croissance et production de bactériocine) en fonction du pH du milieu ne diffère donc que légèrement. La diminution de la production de bactériocine par abaissement du pH, modérée pour Lc. lactis 102 et 53, très forte pour Lc. lactis 99, a également été observée par Uhlman et al. (1992) dans le cas de la bactériocine produite par Lc. lactis D53 et par Piard et al. (1990) en étudiant la production de la lacticine 481 par Lc. lactis CNRZ 481. Ces derniers auteurs ont par ailleurs noté que le pic de production de bactériocine n'est atteint qu'au début de la phase stationnaire, ce qui est également observé dans cette étude. Ce phénomène peut être le fait de la production d'une bactériocine peu active et/ou d'une faible quantité de bactériocine par unité bactérienne, ce qui semble confirmé par le fait que, pour des bactéries dont l'extrait de culture est très actif, comme Lb. brevis DSM 9296 ou E. faecium 81, la production de bactériocine est décelée plus tôt au cours de la phase exponentielle.
Les résultats obtenus semblent montrer que, quelle que soit la souche étudiée, la quantité maximale de bactériocine est produite lorsque le pH du milieu de culture est aux environs de 6. Dans ces conditions, la mesure du diamètre de zone d'inhibition, qui n'est pas directement proportionnelle à la quantité de bactériocine présente dans l'extrait de culture, donne cependant une bonne indication de la quantité de bactériocine produite par chaque bactérie test.
Dans le cas où une des bactéries tests est ensemencée dans le fromage de Munster au début de la période d'affinage, le pH n'excéderait pas généralement 5,5 à la fin de sa phase exponentielle de croissance. Dans ces conditions, seuls Lb. brevis DSM 9296 et Lc. lactis 53 (bien que l'activité dans l'extrait de culture de cette dernière ne soit pas très élevée) devraient produire leurs bactériocines avec un rendement maximal au début de la période d'affinage. Ce rendement de production devrait par contre être particulièrement diminué, par rapport au rendement maximal obtenu à pH 6, pour les souches qui ne produisent pas du tout à pH 5 (Lc. lactis 99 et E. faecalis 96), mais aussi nettement moins bon pour les deux autres souches (E. faecium 81 et Lc. lactis 102).
3. Effet du pH sur l'activité anti-Listeria des bactériocines produites par les différentes souches tests
L'étude précédente (§ 2.2, p. 94), qui visait à apprécier les quantités de bactériocines produites en fin de phase exponentielle de croissance de chaque souche test en fonction du pH, et donc à savoir si les conditions de pH rencontrées au début de la période d'affinage du fromage de Munster sont favorables ou non à la production de bactériocine, est en fait incomplète. En effet, il faut également savoir si ces mêmes conditions (pH 5-6) n'entraînent pas une diminution (ou une disparition) de l'activité de la bactériocine présente.
L'influence du pH sur l'activité anti-Listeria des différentes bactériocines a donc été étudiée, mais en ne se limitant pas aux valeurs de pH précitées. En effet, comme des recontaminations des fromages par L. monocytogenes peuvent se produire tout au long de l'affinage, il est nécessaire de connaître aussi les effets de pH plus élevés (le pH pouvant atteindre 7,5 en fin d'affinage) sur l'activité des bactériocines.
Selon Abee et al. (1994) et Schved et al. (1994c), l'effet du pH sur l'activité des bactériocines est en relation avec l'interaction électrostatique ayant lieu entre la bactériocine et la bactérie sensible. En effet, la paroi (peptidoglycane) et la surface membranaire de celle-ci étant chargées négativement, la bactériocine doit être chargée positivement pour pouvoir entrer en contact avec les cellules bactériennes. Yang et al. (1992) ont notamment observé que l'adsorption de plusieurs bactériocines est fonction du pH et que plus le pH baisse, plus la concentration des bactériocines au niveau de la paroi bactérienne augmente et plus l'effet létal est important. Liu et Hansen (1990) pensent que dans le cas de la nisine, il s'agit de modifications engendrées au niveau des résidus déhydro-acides aminés par des groupements nucléophiles présents à pH élevé. L'effet du pH sur l'activité des bactériocines peut aussi être simplement lié à un problème de solubilité, les bactériocines n'étant pas actives lorsqu'elles ne sont pas en solution. L'exemple le plus connu à ce titre est celui de la nisine qui est active en milieu acide et peu ou pas active à pH plus élevé : sa solubilité passe de 57 mg/ml à pH 2 à 0,25 mg/ml à pH 8 (formation d'oligomères) (Hurst, 1983 ; Liu et Hansen, 1990).
Les éventuelles variations de l'activité anti-Listeria des bactériocines produites par les différentes souches tests en fonction du pH sont appréciées par la mesure du taux de réduction de L. monocytogenes 4d en suspension dans l'extrait de culture de chacune des ces souches, à différents pH, après incubation à 37C. Sachant que, pour chaque souche test, la même quantité de bactériocine est présente aux différents pH, le taux de réduction ne varie donc qu'en fonction de l'activité des molécules bactéricides. Les temps d'incubations sont choisis en fonction de la rapidité de l'action bactéricide des différentes bactériocines (voir tableau XIII, p. 74). Ainsi la durée d'incubation est de 2 h pour Lb. brevis DSM 9296 et E. faecium 81, 4 h pour Lc. lactis (102, 99 et 53) et 18 h pour E. faecalis 96. Les résultats obtenus sont indiqués dans les figures 46 à 51.
Le pH ne semble exercer aucune influence sur l'activité anti-Listeria de la brévicine 9296 et de l'entérocine 81. Quelle que soit la valeur de pH comprise entre 4 et 8, la diminution de la concentration en L. monocytogenes est toujours de l'ordre de 4 unités logarithmiques, à partir d'une population initiale d'environ 107 UFC/ml.
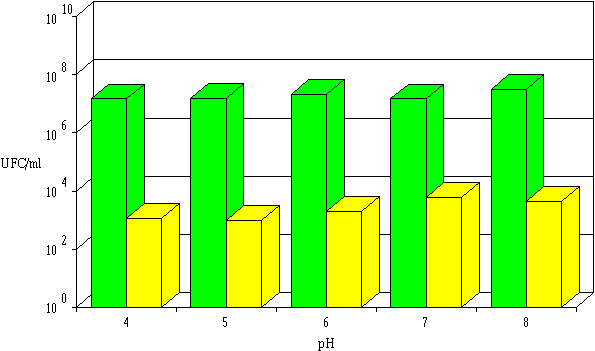
Figure 46
: Activité de la brévicine 9296 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (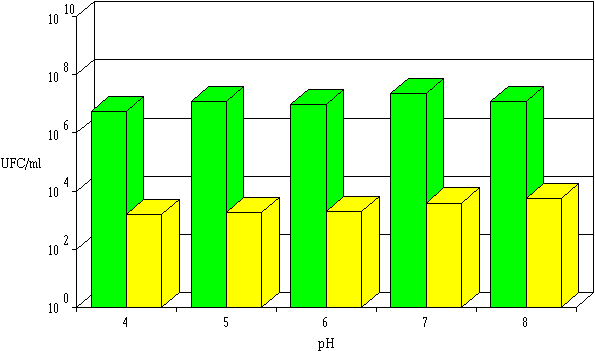
Figure 47 :
Activité de l'entérocine 81 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (L'obtention de tels résultats avec les autres bactériocines d'entérocoques et de lactobacilles n'est pas habituelle. L'entérocine 1146, produite par E. faecium DPC 1146, est peu active à pH 7,5 et son activité augmente pour des pH inférieurs ou supérieurs à cette valeur (Parente et Hill, 1992 b) ; inversement, l'entérocine-100, produite par E. faecium-100, a un optimum d'activité à pH 7 ; son activité diminue en milieu acide et s'annule à pH 5 (Kato et al., 1993). En ce qui concerne les bactériocines produites par les lactobacilles, la plupart présentent un pH optimum d'activité et une baisse notable d'activité lorsque le pH s'écarte de cet optimum (cas de la brévicine 37, produite par Lb. brevis 37 (Rammelsberg et Radler, 1990), de la plantaricine UG1, produite par Lb. plantarum UG1 (Enan et al., 1994) et de la lactacine F, produite par Lb. acidophilus 11088 (Abee et al., 1994)). Seuls Jimenez-Diaz et al. (1993) ont déjà signalé l'existence d'une bactériocine, la plantaricine S produite par Lb. plantarum LPCO 10, dont l'activité ne dépend pas du pH dans une large gamme de pH (3 à 7).
La détermination du nombre de bactéries indicatrices viables après incubation dans l'extrait de culture d'E. faecalis 96 montre une absence d'action bactéricide à pH 7 et à pH 8 (figure 48). Etant donné l'importance de la durée de l'incubation dans cette expérience (18 h), une croissance de L. monocytogenes 4d est même observée à ces pH. L'activité de l'entérocine 96 est importante à pH 4 et 5, tandis que la stabilité de la concentration en L. monocytogenes 4d à pH 6 traduit une activité faible aboutissant à un équilibre entre l'action létale et la multiplication bactérienne.
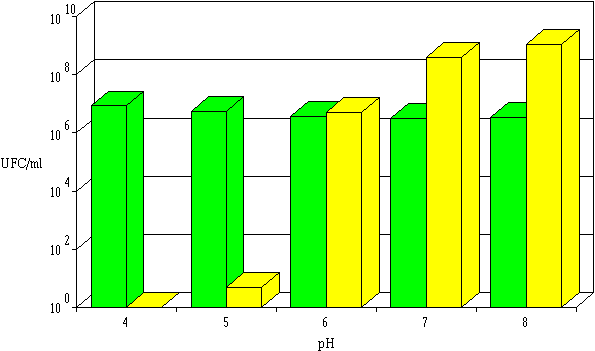
Figure 48
: Activité de l'entérocine 96 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (Le pH peut agir sur l'activité de l'entérocine 96 de différentes manières. En effet, comme cela a déjà été évoqué (p. 103), l'effet du pH se traduit généralement par une modification de la charge de la molécule : le pH doit être assez bas (<pHi) pour que la bactériocine soit chargée positivement et interagisse avec la surface cellulaire chargée négativement. Il ne faut pas négliger également la possibilité d'une faible solubilité de la bactériocine ou d'une dégradation irréversible de la bactériocine (étant donné la longue durée d'incubation (18 h)) aux pH élevés.
Les évolutions de l'activité anti-Listeria des différentes lactococcines produites par Lc. lactis 102, 99 et 53 en fonction du pH sont très similaires (figures 49 à 51) : une activité notable à pH 6 (avec une diminution de 5 unités logarithmiques à partir d'une population d'environ 107 UFC/ml), médiocre à pH 7 et pratiquement nulle à pH 4, 5 (sauf pour la lactococcine 53) et 8.
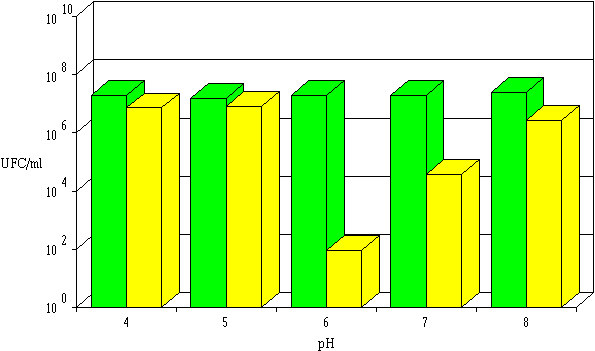
Figure 49
: Activité de la lactococcine 102 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (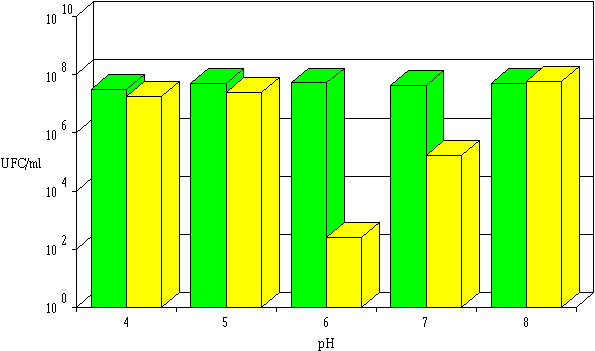
Figure 50
: Activité de la lactococcine 99 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (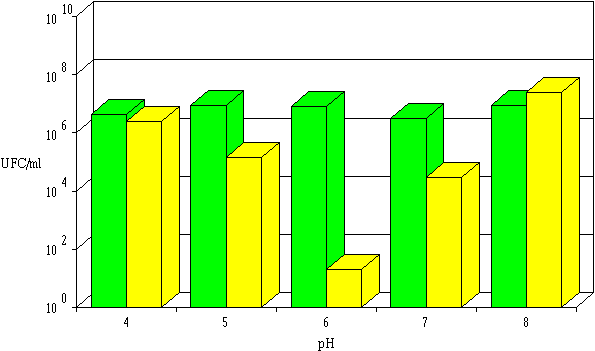
Figure 51
: Activité de la lactococcine 53 dans l'extrait de culture à différents pH : concentrations de L. monocytogenes à 0 h (Contrairement aux lactococcines 102, 99 et 53, les bactériocines produites par les souches de Lc. lactis possèdent généralement des pH optimaux d'activité acides (nisine (Liu et Hansen, 1990 ; Hurst, 1981), lactostrepcines (Kozak et al., 1978) et autres bactériocines (Uhlman et al., 1992)).
Le fait que l'activité anti-Listeria des lactococcines augmente lorsque le pH passe de 8 à 6 peut résulter, comme cela a été observé à propos de l'activité anti-Listeria de l'entérocine 96, d'une augmentation de la charge positive de ces molécules (voir p. 103). La chute brutale de leur activité lorsque le pH devient inférieur à 6 est plus surprenante et plus difficile à expliquer. Elle peut par exemple être due à une diminution de la solubilité des molécules de bactériocines.
Il apparaît qu'autour du pH optimum d'activité de ces lactococcines, les variations de l'activité bactéricide sont importantes : une très faible variation du pH du milieu peut faire passer la bactériocine d'un état d'activité optimale à une absence d'activité. Le pH est donc un facteur déterminant dans leur activité, et cela doit être pris en considération lors de l'éventuelle utilisation de telles substances inhibitrices pour le traitement du fromage de Munster. Il est cependant important de noter que, contrairement à plusieurs bactériocines de souches de Lc. lactis (nisine (Liu et Hansen, 1990 ; Hurst, 1981), lactostrepcines (Kozak et al., 1978) et d'autres bactériocines (Uhlman et al., 1992)) dont l'activité dépend du pH, les lactococcines étudiées présentent l'avantage d'être actives à pH 6 et 7, pH favorables au développement de L. monocytogenes dans les aliments.
L'activité anti-Listeria des souches bactéricides qui serviront éventuellement à ensemencer le fromage de Munster au début de son affinage, dépend à la fois de la production de bactériocines (§ 2.2, p. 94) et de l'activité de ces bactériocines (§ 3, p. 103) à des pH variant de 4,7-5,0 à 5,5-6,0. En conjuguant ces deux paramètres, il est donc possible de se faire une idée sur la quantité de bactériocine active présente dans le bouillon de culture lorsque le pH évolue.
De ce point de vue, la souche test Lb. brevis DSM 9296 est certainement la plus intéressante, d'une part parce que la production de bactériocine, indépendante du pH, correspond à l'activité d'extrait de culture la plus importante, d'autre part parce que cette activité ne dépend pas non plus du pH. Dans ces conditions, quelle que soit la valeur du pH du milieu au moment de l'apparition de L. monocytogenes dans le fromage de Munster, une quantité relativement importante de brévicine 9296 active est garantie.
La production de bactériocine par E. faecium 81 n'est pas optimale à pH 5 (elle est même beaucoup plus faible qu'à pH 6), mais à ce pH l'entérocine 81 produite présente une activité anti-Listeria maximale. Comme cette activité ne dépend pas du pH, il est donc possible que la production de bactériocine, qui aurait lieu au début de la période d'affinage, soit néanmoins suffisante pour éliminer L. monocytogenes dès son apparition dans le fromage de Munster .
E. faecalis 96 a la particularité de ne pas produire de bactériocine à pH 5, alors qu'elle serait active à un tel pH, et de produire une quantité importante de bactériocine à pH 6, alors qu'à ce pH, l'activité bactéricide est négligeable. Utilisée dans le fromage de Munster, cette bactérie ne commencerait à produire sa bactériocine que tardivement, après une éventuelle installation de L. monocytogenes, et la bactériocine produite le serait donc à un pH où son activité serait très faible. L'utilisation d'E. faecalis 96 ne semble donc pas présenter d'intérêt.
La quantité de bactériocines produite par Lc. lactis 102, 99 et 53 et l'activité anti-Listeria de ces bactériocines augmentent très fortement entre pH 5 et pH 6. Il en est donc de même pour la quantité de bactériocine active produite par chacune de ces souches. Si le pH d'apparition de L. monocytogenes est assez proche de 5, celle-ci peut se révéler insuffisante et ne pas empêcher le développement de cette bactérie. L'utilisation des lactocoques pour le traitement anti-Listeria des fromages de Munster paraît donc a priori délicate et aléatoire.
L'activité anti-Listeria des bactériocines produites par les souches tests doit bien sûr être importante lorsque L. monocytogenes risque d'apparaître dans le fromage de Munster (pH 5-6). Mais comme les risques de recontamination dans le fromage existent tout au long de la période d'affinage, il est nécessaire aussi de s'assurer que la quantité de bactériocine active reste également importante lorsque le pH du milieu de culture augmente pour atteindre des valeurs de 7 à 7,5 (correspondantes au pH de la croûte du fromage au terme de l'affinage). Il faut donc tout d'abord savoir si les bactériocines étudiées sont toujours actives à de tels pH. C'est effectivement le cas de la brévicine 9296, produite par Lb. brevis DSM 9296 et de l'entérocine 81, produite par E. faecium 81 (figures 46 et 47). Pour ce qui est des lactococcines (figures 49 à 51), une perte importante de l'activité est notée à pH 7. Quant à l'entérocine 96, produite par E. faecalis 96, elle est tout à fait inactive à pH 7 et 8. Mais, il faut également savoir si, après leur production, les bactériocines actives ne disparaissent pas (de façon irréversible) lorsqu'elles sont maintenues pendant un temps relativement long (au moins la durée d'affinage, c'est-à-dire de 3 à 6 semaines) à 15C et dans un milieu où le pH évolue lentement de 5,5 à 7,5.
4. Stabilité des différentes bactériocines en fonction du pH
Il s'agit, au cours de cette étude, de comparer la stabilité des différentes bactériocines dans les extraits de cultures à différents pH (de 4 à 8) et à une température de 15C. L'évolution de l'activité des extraits de cultures (donc de la stabilité des bactériocines) au cours du temps est suivie par titrage suivant la méthode de Mayr-Harting et al. (1972).
Les mécanismes d'inactivation des bactériocines sont assez mal connus, mais selon Liu et Hansen (1990), celle-ci peut être la conséquence d'une dénaturation (changement de conformation) et/ou d'une modification de la structure primaire des bactériocines. Certaines modifications chimiques, comme celles observées par Liu et Hansen (1990) dans le cas de la nisine (multimérisation) et par Larsen et al. (1993) dans le cas de la bavaricine A (Lb. bavaricus MI401) apparaissent réversibles par un changement du pH. Dans le cas de la nisine, Liu et Hansen (1990) pensent qu'il s'agit de modifications engendrées au niveau des résidus déhydro-acides aminés par des groupements nucléophiles présents à pH élevé, modifications réversibles cependant par abaissement du pH. D'autres modifications font intervenir la configuration spatiale de la bactériocine (comme dans le cas d'une rupture des liaisons disulfures) (Schved et al., 1994c). L'importance de ces processus d'inactivation réversibles, déjà évaluée (§ II.3, p. 103), ne sera pas appréciée par l'étude entreprise puisque tous les extraits de culture sont ajustés à pH 6 lors du titrage. Seule l'importance d'éventuels processus d'inactivation irréversibles sera donc mesurée et cela est bien l'objectif recherché.
Les résultats obtenus sont présentés dans les figures 52 et 53. Ils confirment les observations déjà faites lors de l'étude de la production des bactériocines à pH régulé et à 37C (voir figures 40-45, p. 95-101), à savoir que la stabilité des bactériocines diminue lorsque le pH du milieu augmente..
Aucune modification de l'activité de l'extrait de culture de Lb. brevis 9296 n'est notée après 47 j à 15C lorsque le pH est de 5 ou 6. Par contre, à pH 7, si l'activité reste stable durant les premiers jours, elle diminue ensuite et ne représente plus que 6% de l'activité initiale après 47 j (figure 52a). La durée d'affinage du fromage de Munster à 15C n'étant en moyenne que d'environ 4 semaines et le pH n'atteignant 7 qu'en toute fin de cette période, l'activité anti-Listeria de la bactériocine produite dans le fromage de Munster par le développement de Lb. brevis DSM 9296 ensemencé au début de l'affinage, devrait donc se maintenir sensiblement égale durant toute cette période au cours de laquelle les risques de contamination par L. monocytogenes (du fait des lavages successifs) sont les plus importants.
Aucune perte d'activité de l'entérocine 81 n'est mesurée à pH 5, et à pH 6 et 7, cette activité est encore de 50% au delà même de la période normale de durée de l'affinage des fromages de Munster (figure 52b). Seul un pH de 8 provoque une dégradation plus importante de la bactériocine, mais cela importe peu étant donné que le pH du fromage dépasse rarement 7 en fin d'affinage. Au cours de l'affinage des fromages de Munster, l'entérocine 81 produite dans cet aliment devrait garder au moins 50% de son activité anti-L. monocytogenes jusqu'à la fin de la période d'affinage.
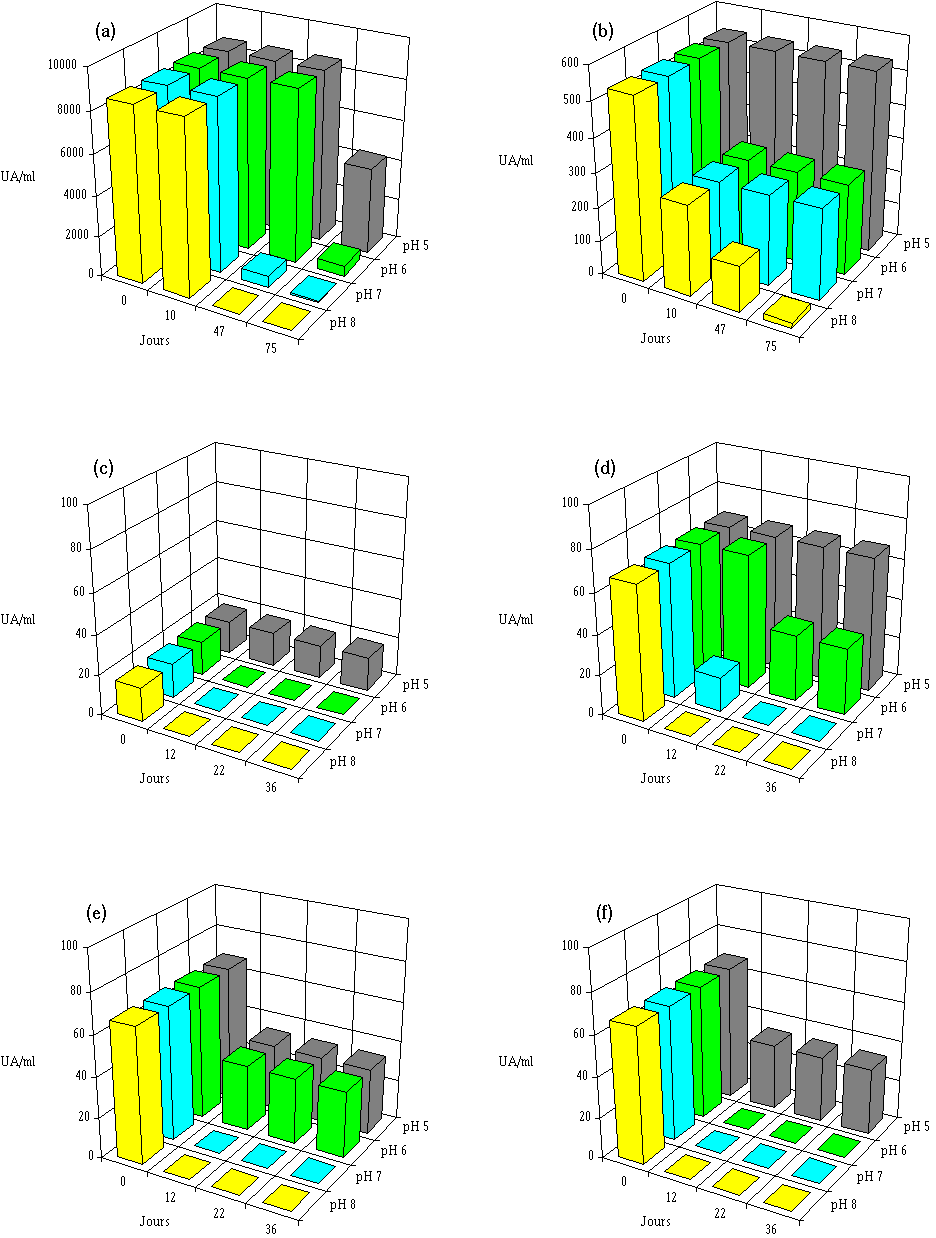
Figure 52
: Stabilité des différentes bactériocines à 15C dans l'extrait de culture à différents pH. (a) brévicine 9296, (b) entérocine 81, (c) entérocine 96, (d) lactococcine 102, (e) lactococcine 99, (f) lactococcine 53L'activité de l'extrait de culture d'E. faecalis 96 étant très faible (elle correspond à l'activité minimale mesurable (17 UA/ml)), il est difficile d'étudier l'effet du pH sur la stabilité de la bactériocine active (figure 52c). Il apparaît toutefois que, comme dans le cas des bactériocines produites par E. faecium 81 et Lb. brevis DSM 9296, l'entérocine 96 semble moins stable lorsque le pH augmente : à pH 5, l'activité est conservée dans l'extrait de culture jusqu'à la fin de l'incubation (36 j) ; à pH plus élevé l'activité a totalement disparu après 12 j d'incubation. L'entérocine 96 est donc dégradée rapidement à 15C lorsque le pH dépasse 5, c'est-à-dire dans les conditions de pH rencontrées lors de l'affinage des fromages de Munster.
La lactococcine 102 est très stable à pH 5. A pH 6, 50% de son activité est conservée après 36 j. A pH 7 par contre, la totalité de l'activité disparaît après 22 j d'incubation (figure 52d). Etant donné que le pH des fromages de Munster dépasse généralement une valeur de 6 dans la deuxième moitié de la période d'affinage, la lactococcine 102 risque donc d'être dégradée dans de telles conditions.
La lactococcine 99 est moins stable que la lactococcine 102 puisqu'une dégradation de la bactériocine est constatée à pH 5 (figure 52e). Une inactivation totale est par ailleurs observée aux pH supérieurs à 6 après seulement 12 j d'incubation. Si elle est utilisée dans le fromage de Munster, cette bactériocine peut être dégradée, particulièrement vers la fin de la période d'affinage.
La lactococcine 53 est encore moins stable dans l'extrait de culture que les lactococcines 99 et 102. En effet, une baisse de l'activité bactéricide, de 50% à pH 5 et de 100% à pH 6, est déjà constatée à partir de 12 j d'incubation (figure 52f). La lactococcine 53 serait donc inactivée dès les premiers jours de la période d'affinage, puisque le pH dépasse rapidement la valeur de 5.
Les résultats obtenus pour toutes les bactériocines étudiées font donc apparaître une meilleure stabilité de l'activité bactéricide avec l'abaissement du pH.
Des études faites sur des bactériocines de lactobacilles ont également abouti à des résultats similaires (Jimenez-Diaz, 1993 ; Vaughan et al., 1992 ; Larsen et al., 1993). Concernant les entérocoques, les bactériocines produites par d'autres souches d'E. faecium sont également plus stables aux valeurs de pH faibles (Parente et Hill, 1992a ; Kato et al., 1993). Les travaux de Lopez-Lara et al. (1991) concluent à l'instabilité de la bactériocine produite par E. faecalis ssp. liquefaciens B-48-28 aux pH faibles (<5,5). Les résultats concernant la stabilité des bactériocines produites par d'autres souches de Lc. lactis divergent. C'est ainsi que la stabilité de la nisine et des lactostrepcines augmente avec la diminution du pH (Hurst, 1981 ; Nettles et Barefoot, 1993), tandis que la lacticine 481 (Lc. lactis CNRZ 481) est plus stable à pH 7 qu'à pH 4,5 (Piard et al., 1990).
Il faut noter par ailleurs que le maintien des extraits de culture des différentes bactéries tests dans des conditions de stockage du fromage de Munster (4C et pH 6-8) a montré également une rapide dégradation à pH 8, mais un maintien d'au moins 50% de l'activité bactéricide à pH 6 et 7 (correspondant mieux aux conditions de stockage) jusqu'à la fin des 6 semaines que dure le stockage des fromages de Munster.
Le processus d'inactivation irréversible des bactériocines peut correspondre à une hydrolyse par des protéases spécifiques produites par la souche bactériocinogène à la fin de sa phase exponentielle de croissance (Geis et al., 1983) (et qui seront en partie seulement retrouvées dans l'extrait de culture). Un tel processus a été déjà mis en évidence par Piard et al. (1990) pour la lacticine 481 (Lc. lactis CNRZ 481) et par Jimenez-Diaz et al. (1993) pour la plantaricine S (Lb. plantarum LPCO 10). Dans le but d'évaluer le rôle de cette hydrolyse dans l'inactivation des bactériocines étudiées, les extraits de culture des différentes souches tests (pH 6) sont chauffés à 100C pendant 10 min. Dans ces conditions, l'activité des bactériocines, peu dépendante de la température (sauf pour l'entérocine 96) (tableau XVI), est maintenue ou seulement partiellement dégradée, alors que celle des protéases est a priori supprimée.
Tableau XVI
: Sensibilité des bactériocines étudiées à différents traitements thermiques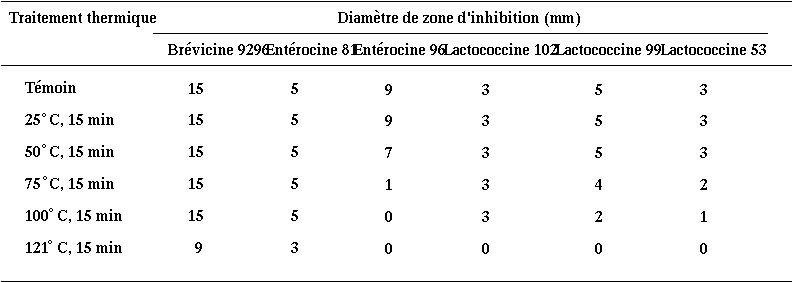
Les résultats indiqués dans la figure 53 montrent effectivement un meilleur maintien de l'activité anti-Listeria des bactériocines après traitement des extraits de culture par la chaleur (sauf en ce qui concerne la lactococcine 102 pour laquelle il n'y a pas d'amélioration et, bien sûr, l'entérocine 96 qui est inactivée à 100C). La dégradation de l'entérocine 81 semble imputable uniquement à l'action des protéases. Pour les autres bactériocines, leur dégradation ne peut être que partiellement attribuée à ces enzymes. D'autres causes, non élucidées, y contribuent également.
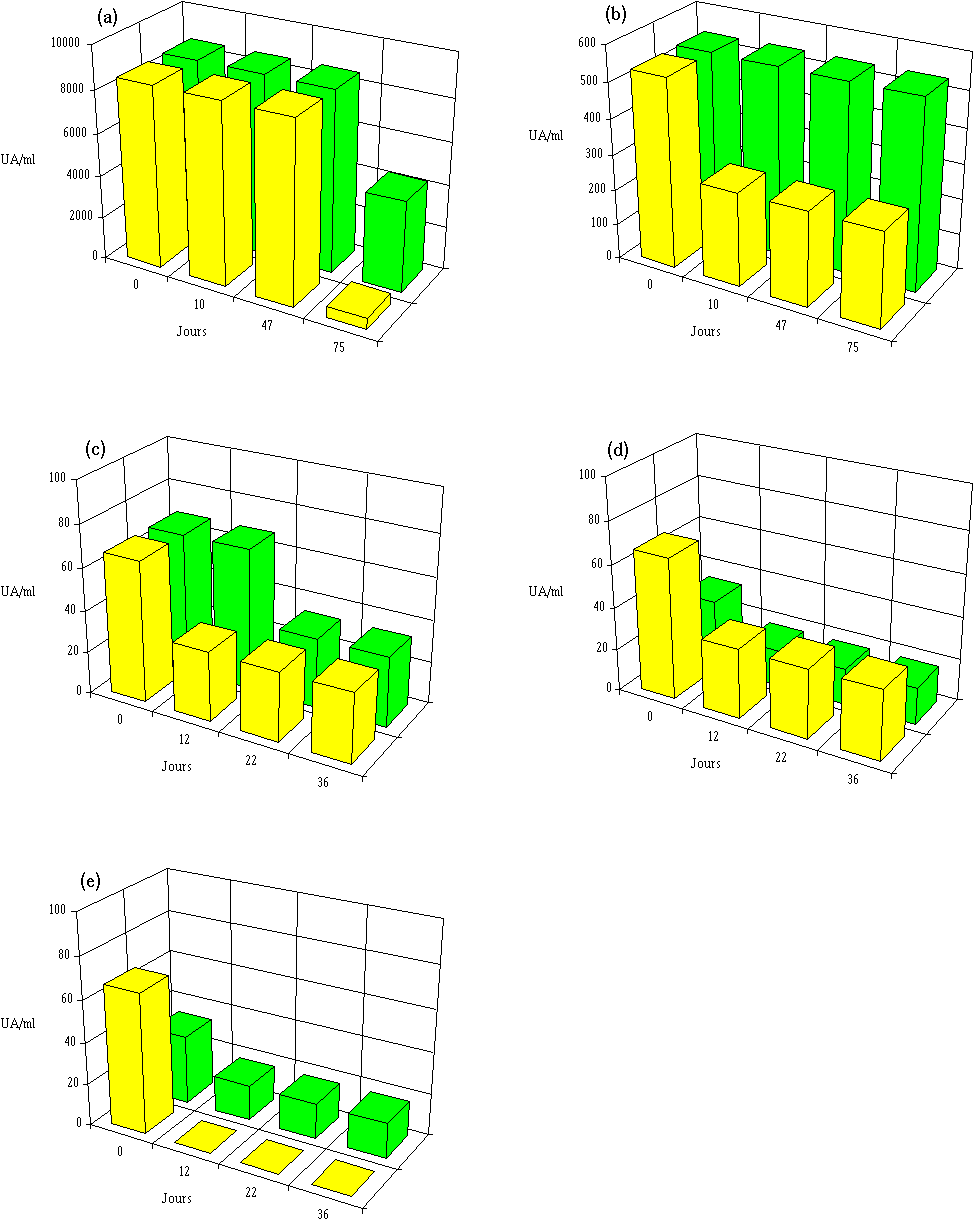
Figure 53
: Stabilité des différentes bactériocines à 15C dans l'extrait de culture à pH 6, avec (
Conclusion
Les résultats de cette étude montrent bien que les quantités de bactériocines produites par les différentes souches tests, leur activité et leur stabilité sont influencées par les conditions de culture telles que le pH et la température du milieu (tableau XVII).
Les bactéries étudiées se développent bien à une température de 15C, avec une production de bactériocine exclusivement pendant la phase exponentielle de croissance.
En combinant les différents résultats obtenus dans ce chapitre concernant l'étude de l'effet du pH sur la production, l'activité et la stabilité des bactériocines, il est possible de comparer les différentes souches bactériocinogènes (tableau XVII).
Tableau XVII : Résumé des caractéristiques de production, d'activité et de stabilité des bactériocines produites par les souches bactériennes isolées des fromages de Munster
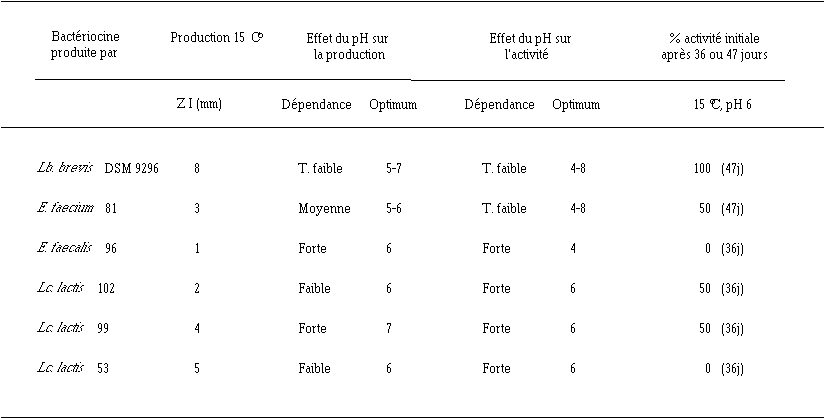
Parmi toutes les bactéries bactériocinogènes étudiées, Lb. brevis DSM 9296 est certainement la plus intéressante pour une utilisation dans les fromages de Munster. En effet, au début de l'affinage du fromage (pH 5-6), la production et l'activité de la bactériocine seraient optimales. Dans ces conditions, quelle que soit la valeur de pH du milieu au moment de l'apparition de L. monocytogenes dans le fromage de Munster, une quantité relativement importante de brévicine 9296 active serait produite. Vers la fin de la période d'affinage (pH 6-7), la bactériocine serait encore stable et toujours aussi active, ce qui empêcherait les recontaminations du fromage.
De telles constatations (activité constante quel que soit le pH entre 4 et 8, bonne stabilité dans cette zone de pH) sont également valables pour l'entérocine 81 produite par E. faecium 81. Toutefois, la production de cette bactériocine baisse notablement lorsque le pH passe de 6 à 5. Cela signifie que la quantité d'entérocine active produite en début d'affinage dans le fromage de Munster, donc lorsque L. monocytogenes est susceptible d'apparaître, risque de ne pas être optimale.
La quantité de lactococcines actives (102, 99 et 53), faible à pH 5, augmente très fortement entre pH 5 et 6. Lorsque le pH dépasse 6, ces lactococcines, non seulement perdent leur activité, mais en plus se dégradent de façon irréversible (spécialement la lactococcine 53). Dans ces conditions, la quantité de bactériocines actives dans le fromage de Munster risque d'être faible lors de l'apparition de L. monocytogenes si le pH est, comme c'est souvent le cas, plus proche de 5 que de 6 et insuffisante dans la deuxième partie de l'affinage, d'où la possibilité de nouvelles contaminations de l'aliment. L'utilisation des souches de lactocoques paraît donc inadaptée pour lutter contre L. monocytogenes dans le fromage de Munster.
E. faecalis 96 ne produit pas d'entérocine 96 à un pH proche de 5, alors qu'elle serait active à un tel pH. Autour de pH 6, elle produit des quantités notables de bactériocine, mais celle-ci n'a plus d'activité bactéricide. Son utilisation comme souche bactériocinogène anti-Listeria dans les fromages de Munster ne peut donc être envisagée.
Il apparaît donc que les deux souches tests les mieux adaptées au traitement anti-Listeria des fromages de Munster sont Lb. brevis DSM 9296 et, dans une moindre mesure, E. faecium 81. Ce sont aussi les deux souches dont les extraits de culture présentent à pH 6 la plus grande activité anti-Listeria (tableau X, p. 47).
Les résultats obtenus dans ce chapitre ont certes permis de sélectionner les deux souches les plus actives en bouillon de culture dans les conditions de pH et de température rencontrées lors de l'affinage du fromage de Munster, mais l'activité de ces souches doit de toute façon être confirmée par des essais sur l'aliment. En effet, le passage d'une culture pure de la souche bactériocinogène (ou en présence de L. monocytogenes uniquement) dans un milieu de composition simple à un système de composition chimique complexe, le fromage, (adsorptions, complexation, hydrolyse,...) et où se produisent des interactions multiples (antagonisme ou symbiose) entre des microorganismes très variés, peut influer grandement sur l'activité antibactérienne de cette souche et sur la croissance de L. monocytogenes.