

Les Listeria sont des bactéries bacilles Gram + courts et réguliers. Parmi les espèces de ce genre, seule L. monocytogenes, espèce la plus fréquemment rencontrée dans les aliments (65% selon Larpent, 1995), est l'agent causal de la listériose chez l'homme.
La listériose frappe surtout les femmes enceintes, les personnes âgées et les malades immunodéprimés, en particulier les personnes atteintes du SIDA qui sont 150 fois plus touchées que le reste de la population (Farber et Peterkin, 1991). En France, la fréquence de la maladie a été estimée en 1984 par Goulet et al. (1986) à 11,4 cas par million d'habitants. Selon les estimations les plus récentes (Jackson, 1993), le nombre annuel de cas de listériose est de l'ordre de 350 en France et de 1850 aux Etats-Unis, dont respectivement, 110 et 460 cas mortels. Parmi les épidémies les plus récentes, celle d'août 1992 en France a concerné 108 personnes et a provoqué 21 décès et 5 avortements. Le taux de mortalité par la listériose est en général de l'ordre de 20%, mais atteint 30% chez les nouveau-nés et 50% chez les immunodéprimés (Catteau, 1992). L. monocytogenes pénètre chez l'hôte par voie digestive, traverse la barrière intestinale et se multiplie après phagocytose par les macrophages (McDonalds et Carter, 1980). Les manifestations de la maladie sont multiples (méningites, encéphalites, septicémies, avortements,...).
La listériose est transmise à l'homme par les aliments carnés, laitiers, les plats cuisinés, les légumes crus,... L'origine alimentaire de la listériose humaine s'explique aisément par le caractère ubiquitaire de L. monocytogenes (présente dans le sol, la végétation, l'eau,...) dû à certaines caractéristiques générales du genre Listeria. Il s'agit en effet de bactéries capables de survivre et de se développer dans des conditions généralement défavorables à la croissance bactérienne (froid, solutions salines, pH bas (4,5-5)). Toutefois, malgré la fréquence du contact de l'homme avec la bactérie, les infections ne se déclarent qu'à l'occasion de la présence de souches virulentes, ce qui n'est pas le cas fort heureusement de la plupart des souches de L. monocytogenes (Farber et Peterkin, 1991).
Bien que L. monocytogenes soit retrouvée dans de nombreuses denrées alimentaires, les produits laitiers sont les plus fréquemment associés à la transmission de la listériose. La fréquence de la contamination varie entre 5 et 56% dans les échantillons de lait cru (Hayes et al., 1986 ; Garcia y Garcia, 1993) et elle est de 12% en moyenne dans les échantillons de fromages (Prasad et Gupta, 1990). Cependant, contrairement aux fromages à pâte fraîche, dure ou persillée dans lesquels la croissance de L. monocytogenes est généralement inhibée, les fromages à pâte molle (croûte fleurie ou lavée) sont souvent le siège d'une multiplication importante de la bactérie au moment de la remontée du pH qui accompagne l'affinage et leur fréquence de contamination par L. monocytogenes est bien plus élevée (de l'ordre de 25 à 30% selon Skovgaard et al., 1988), avec des concentrations atteignant parfois 104 UFC/g. L'épidémie la plus connue causée par cette catégorie de fromages est celle survenue en Suisse (de 1983 à 1987), résultant de la consommation de fromages contaminés de type vacherin Mont d'Or, et qui a provoqué la mort de 33 personnes sur 122 atteintes.
Les fromages à pâte molle ont alors fait l'objet d'une mesure réglementaire stricte imposant l'absence de toute contamination dans 25 g de produit (Anon., 1994). Toutefois, une telle norme reste difficile à respecter par les producteurs, car les mesures d'hygiène prises, bien que contraignantes, ne sont pas toujours efficaces, étant donné la capacité de survie de L. monocytogenes, par exemple dans le sérum stagnant dans les fissures du sol, ainsi qu'au niveau des regards d'égoûts et autres orifices (Barnier et al., 1988). Aussi, la contamination des fromages à pâte molle par L. monocytogenes est-t-elle restée à la fois un problème santé publique et un problème économique difficile à résoudre.
Au cours de ce travail, deux méthodes de lutte contre L. monocytogenes dans des fromages à pâte molle et à croûte lavée de type Munster sont proposées, comme moyens complémentaires aux bonnes pratiques d'hygiène dans les lieux de fabrications et d'affinage. La première méthode proposée utilise les rayonnements ionisants. Dans le cas, le principal problème est de trouver la dose d'ionisation suffisante pour éliminer les concentrations de L. monocytogenes les plus élevées retrouvées dans cet aliment, sans entraîner d'altérations organoleptiques. Un tel traitement interviendrait sur le fromage affiné emballé. La deuxième méthode concerne l'utilisation de bactéries, notamment lactiques, originaires du fromage lui-même et ayant un pouvoir antagoniste vis-à-vis de L. monocytogenes par la production de substances de types bactériocines.


Le traitement ionisant des fromages de Munster en vue d'éliminer L. monocytogenes
Introduction
Les études réalisées en vue d'évaluer la sensibilité de Listeria monocytogenes aux radiations ionisantes ont montré que la DRD (dose de réduction décimale) de cette bactérie varie suivant la nature du substrat ionisé. Ainsi les DRD mesurées dans un tampon phosphate (de 0,32 kGy à 0,49 kGy selon Patterson (1989)) ou dans un bouillon nutritif (de 0,31 kGy à 0,49 kGy selon Huhtanen et al. (1989) et de 0,34 kGy à 0,50 kGy selon El-Shenawy et al. (1989)) apparaissent plus faibles que celle obtenues dans des aliments carnés (de 0,59 kGy à 1,03 kGy dans la viande de volaille selon Huhtanen et al. (1989) et de 0,51 kGy à 1,0 kGy dans la viande de boeuf hachée selon El-Shenawy et al. (1989)). La plus grande radiorésistance de la bactérie dans les produits carnés peut être attribuée à la faible teneur en eau (de l'ordre de 10%) de ces aliments comparée à celle du bouillon nutritif, puisqu'il est établi que la radiosensibilité est plus élevée en milieu aqueux qu'en milieu sec (Taub, 1983). En effet, les rayonnements ionisants ont un effet antibactérien direct, mais peuvent, par radiolyse de l'eau, libérer des espèces réactives (radicaux hydroxyles, radicaux hydrogènes et électrons hydratés) qui vont accroître cet effet. De plus, certains composants de l'aliment, tels que les protéines, peuvent réagir avec les radicaux libres formés lors de l'ionisation et ainsi protéger les bactéries (Urbain, 1986).
La DRD peut varier également de façon notable en fonction des souches de L. monocytogenes utilisées, comme cela a été montré par Farag et al. (1990) qui ont obtenu des valeurs de 0,21 ; 0,25 et 0,46 kGy pour trois souches différentes de L. monocytogenes dans un bouillon nutritif. Des DRD de 0,34 kGy à 0,50 kGy, suivant les souches, ont été obtenues par El-Shenawy et al. (1989), également dans un bouillon nutritif. L'état physiologique des différentes souches testées n'est cependant pas précisé.
Par contre, il ne semble pas que la DRD dépende du débit de dose du rayonnement ionisant utilisé. Il a en effet été rapporté par Farag et al. (1990) et Patterson (1989) que la radiosensibilité de L. monocytogenes ne variait pas, quel que soit le traitement utilisé (rayonnements ou électrons accélérés).
Les mesures de DRD de L. monocytogenes réalisées jusqu'à présent ont été effectuées uniquement sur des produits carnés. Bien qu'aucune donnée concernant les produits laitiers ne soit disponible, les DRD obtenues dans ce type d'aliment doivent sans doute être comparables à celles obtenues dans la viande de volaille ou dans la viande de boeuf hachée (ce point sera néanmoins vérifié au cours de cette étude). Compte tenu des valeurs de DRD de L. monocytogenes déterminées dans les aliments et des concentrations de cette bactérie habituellement rencontrées (102 à 105 UFC/g ou ml) dans les produits laitiers, il est donc possible d'envisager l'utilisation des rayonnements ionisants à des doses relativement faibles (1 à 2,5 kGy) afin d'éliminer cette bactérie.
L'emploi des radiations ionisantes en industrie laitière reste cependant freiné par le développement de goûts et d'odeurs indésirables à des doses bien inférieures à celles nécessaires pour pasteuriser l'aliment : Sadoun (1987) a par exemple indiqué l'apparition d'odeurs anormales et désagréables dans le lait cru traité, dès que la dose d'ionisation dépasse 0,25 kGy, alors que selon Rosenthal et al. (1983), une qualité bactériologique satisfaisante du lait cru, en ce qui concerne la flore totale, les coliformes et les germes psychrotrophes, n'est obtenue qu'à une dose de 4 kGy. Quant à la dose nécessaire pour stériliser le lait cru, elle semble supérieure à 15 kGy (Day et al., 1957a et b). L'ionisation du lait liquide à température ordinaire et à une dose de 0,25 kGy ne permet en fait qu'une réduction du nombre de germes aérobies mésophiles d'un facteur de 10 (Sadoun et al., 1989).
En ce qui concerne le lait en poudre, l'étude faite par Rosenthal et al. (1983) a montré des changements de couleur et de flaveur à partir d'une dose d'ionisation de 2 kGy, aussi bien dans la poudre que dans le lait reconstitué.
Selon Jones et Jelen (1988), une dose de 0,75 kGy réduit de 96% et 99% la population microbienne, respectivement dans les fromages de Camembert (pâte molle) et Cottage (pâte fraîche). Toutefois, des changements organoleptiques sont détectés à partir d'une dose de 0,30 kGy dans le fromage de Camembert et de 0,75 kGy dans le fromage Cottage. En ce qui concerne les fromages de type Gouda (pâte cuite), plus secs que les précédents, l'ionisation à une dose de 0,6 kGy permet d'éliminer les coliformes présents à une concentration de 103 UFC/g sans aucune altération du goût de l'aliment (Rosenthal et al., 1983).
L'apparition de flaveurs désagréables, qui constitue un problème majeur lors du traitement ionisant des produits laitiers, est souvent attribuée à l'oxydation des lipides et des protéines (Lee et al., 1993). Pour ce qui est du lait, Goresline (1966) a attribué ces flaveurs désagréables à l'altération des acides gras insaturés entrant dans la composition des phospholipides. Hoff et al. (1959) ont identifié l'acide linolénique comme étant le précurseur des mauvaises odeurs issues de l'oxydation de la matière grasse du lait traité par ionisation. Des changements dans la structure des protéines sont également rendus responsables de certaines mauvaises odeurs du lait ionisé. Ces changements peuvent inclure des désaminations, des décarboxylations, des réductions de ponts disulfures, des oxydations de groupements sulfhydryles, des clivages ou des agrégations de chaînes peptidiques (Delincée, 1983). Selon Day et al. (1957a), des produits issus de la dégradation de la caséine, tels que le sulfure de méthyle, le disulfure de méthyle et le méthyl mercaptan, seraient à l'origine des mauvaises odeurs du lait écrémé ionisé. Hsu et al. (1972) ont mesuré une augmentation des groupements sulfhydryles libres et des produits volatils dans le lait écrémé en poudre ionisé à 16 kGy. Ces produits seraient responsables des mauvaises odeurs perçues après la reconstitution du lait. Selon Jones et Jelen (1988), les modifications organoleptiques engendrées par la lipolyse auraient lieu à partir de doses d'ionisation plus faibles que celles nécessaires pour entraîner des modifications dues à la dégradation de la caséine ou des protéines du sérum. Les modifications organoleptiques sont également amplifiées en présence d'oxygène, et notamment si l'ionisation est effectuée sous air (Langley-Danysz, 1985). La production de produits de dégradation, même en faibles quantités, est suffisante pour faire apparaître des goûts et des odeurs désagréables, rendant l'aliment impropre à la consommation (Wertheim et Proctor, 1956, Day et al., 1957b). Par ailleurs, le type de rayonnement utilisé (c'est à dire le débit de dose) ne semble pas avoir d'effet sur la dose à laquelle les altérations apparaissent (Gerrard, 1970).
Afin de réduire les répercussions de l'ionisation sur la qualité organoleptique des produits laitiers, Hashisaka et al. (1990) ont proposé un traitement ionisant à basse température. Un traitement de 40 kGy à -78 C (stérilisant pour certains produits laitiers) ne provoque que des modifications mineures de couleur et de texture, avec une légère baisse de l'acceptabilité générale. Si de plus, le traitement est réalisé en atmosphère modifiée ou en présence d'anti-oxydants, il est possible de préserver totalement les propriétés organoleptiques et même parfois d'améliorer l'appréciation globale des produits laitiers (Hashisaka et al., 1990). Il faut noter que l'application de tels procédés reste limitée, essentiellement pour des raisons économiques, et n'a été envisagée que pour la stérilisation des aliments destinés à des malades immunodéprimés.
L'ionisation des aliments lactés à température ambiante, sans provoquer de modifications organoleptiques, est cependant envisageable, à conditions de réaliser le traitement de façon astucieuse. C'est ainsi que l'ionisation aux rayons des fromages de Camembert au lait cru, en vue d'éliminer L. monocytogenes, mais aussi Salmonella sp., Escherichia sp. et Staphylococcus sp. est possible (et autorisé en France (Anon., 1993)) à condition que le produit soit traité emballé, au début de la période d'affinage. Dans ces conditions, aucune altération organoleptique ne résulte de l'ionisation.
Un tel protocole ne peut être utilisé dans le cas d'un fromage à pâte molle et croûte lavée, comme le fromage de Munster (pour l'élimination de L. monocytogenes). Mais d'autres solutions, visant à réduire la dose totale de rayonnements absorbés par l'aliment, peuvent être éventuellement proposées, si le mode de contamination par L. monocytogenes et la localisation de cette bactérie dans le fromage sont connus.
Matériel et méthodes
I. Echantillons
L'étude est réalisée sur des fromages de Munster de 17 cm de diamètre provenant d'une fromagerie locale. Selon le cas, les échantillons sont soit de fabrication industrielle (au lait cru ou pasteurisé), soit d'origine fermière. Tous les échantillons sont affinés dans une même cave d'affinage, dans des conditions de température et d'humidité contrôlées, et sont pris à différents stades de maturation selon les essais.
Dans la suite du texte, les fromages préparés industriellement seront simplement dénommés "fromages de Munster au lait cru" ou "fromages de Munster au lait pasteurisé". Les fromages d'origine fermière seront dénommés "fromages de Munster fermiers".
Tous les essais réalisés utilisent des fromages naturellement contaminés par L. monocytogenes, à l'exception de ceux effectués pour mesurer la dose de réduction décimale de cette bactérie.
II. Détermination de la dose de réduction décimale
La souche de L. monocytogenes 1/2c utilisée a été isolée à partir de produits alimentaires dans le laboratoire. Elle est maintenue à -80 C dans 30% de glycérol et 70% de bouillon cerveau-coeur et reprise sur gélose de conservation de souches pour la conservation de courte durée (à 4C). Une culture de 18 h est réalisée dans un bouillon TSL (tryptone-soja et extrait de levures) à 30C afin d'atteindre la phase stationnaire de croissance (108 UFC / ml).
Du fromage en fin d'affinage (18 g), exempt de L. monocytogenes ou faiblement contaminé (< 102 UFC/g), est mis dans un sac stomacher contenant 2 ml de la culture de L. monocytogenes. L'échantillon est alors broyé pendant 90 sec pour assurer une homogénéisation du mélange. Le sac stomacher est ensuite étalé pour avoir une épaisseur d'environ 5 mm, ce qui permettra un traitement ionisant uniforme, même avec des électrons accélérés de faible énergie (2,2 MeV). Le traitement ionisant, combiné au froid (4C), est réalisé dans une gamme de doses allant de 0,5 à 3,0 kGy. L'analyse des échantillons après traitement porte sur 10 g de produit.
L'évolution de la teneur des échantillons en L. monocytogenes viable (log UFC/g) en fonction de la dose d'ionisation est étudiée. Dans le cas où cette relation est linéaire, la pente de la droite de régression représente la dose de réduction décimale.
III. Analyse microbiologique
1. Méthodologie de prélèvement
Le prélèvement est de 25 g de croûte ou de coeur du fromage pour l'analyse microbiologique. Le prélèvement de la croûte (<6 mm d'épaisseur) est réalisé à l'aide d'un couteau stérilisé à l'alcool iodé puis repassé à la flamme. Les 25 g de croûte sont ajoutés aseptiquement à 225 ml de bouillon TSL et homogénéisés pendant 1,5 min au broyeur type stomacher.
Le prélèvement au coeur du fromage est précédé d'un léger passage de la surface de coupe à la flamme, d'une restérilisation du couteau et de l'élimination de la partie superficielle touchée par la flamme. Les 25 g de coeur sont ensuite traités de la même manière que les 25 g de croûte.
Une partie de l'homogénat obtenu (200 ml) est enrichie en présence d'inhibiteurs sélectifs : acriflavine (Sigma), acide nalidixique (Sigma) et cycloheximide (Sigma) (voir proportions en annexe I). Elle constitue le bouillon d'enrichissement qui est incubé pendant 24 h et 7 j à 30C et sert à la recherche de L. monocytogenes. Les 50 ml d'homogénat restant servent à la numération des différentes flores et constituent la dilution de base (10-1) à partir de laquelle sont effectuées des dilutions décimales de plus en plus importantes selon l'abondance de la flore recherchée (1 ml de la dilution inférieure est dilué dans 9 ml d'un liquide de dilution TS (tryptone-sel)).
2. Dénombrement et recherche de L. monocytogenes
Les échantillons sont le plus souvent peu riches en L. monocytogenes au stade où l'analyse est effectuée. Il faut donc arriver à mettre en évidence une ou quelques cellules de L. monocytogenes dans 25 g de fromage contenant généralement une flore lactique très abondante. Le recours à des méthodes d'enrichissement sélectif s'avère alors nécessaire ; celle choisie pour cette étude est la méthode FDA modifiée (Anon., 1994) (voir annexe II) recommandée actuellement pour l'analyse des fromages et rédigée à partir des travaux de Lovett (1988).
Le dénombrement est réalisé à partir de la dilution de base (10-1) dont 0,1 ml est prélevé et étalé sur milieu Oxford gélosé (Curtis et al., 1989). Les boîtes de Pétri sont ensuite incubées à 37C pendant 48 h.
Les isolements sur milieu Oxford sont réalisés à l'aide d'une anse à partir du bouillon d'enrichissement, après 24 h et 7 j d'incubation à 30C ; les boîtes de Pétri sont ensuite incubées 48 h à 37C. En présence de colonies suspectes (colonies vert-olive avec un centre effondré et noir), 5 d'entre elles sont repiquées en stries sur gélose au sang. Après incubation à 35C pendant 24 h, le pouvoir hémolytique de la bactérie isolée est constaté. A partir des mêmes stries, sont réalisés un test à la catalase sur lame et une coloration de Gram.
Une purification sur gélose Oxford est effectuée, ce qui permet, après incubation 48 h à 37C, d'avoir un clonage homogène. Une colonie bien isolée est alors repiquée en double strie sur gélose au sang, l'incubation se faisant à 35C pendant 24 h. Cela permet de confirmer le pouvoir hémolytique et d'avoir assez de culture pour faire une galerie d'identification, comportant les tests suivants (les caractéristiques de L. monocytogenes sont indiquées entre parenthèses) :
-fermentation des hydrates de carbone à savoir : xylose (-), rhamnose (+), mannitol (-),
-dégradation du glucose (+) et du lactose (+) sur milieu Kligler,
-production de H2S sur milieu Kligler (-),
-dégradation des nitrates sur bouillon nutritif aux nitrates (-),
-dégradation des sucres en acides mixtes : test au rouge de méthyle sur milieu de Clark et Lubs (+),
-production d'acétoïne (voie d'attaque des sucres) : test de Voges-Proskauer sur milieu de Clark et Lubs (+),
-dégradation de l'urée : sur le milieu Urée Christensen (-),
-mobilité sur gélose de mobilité (+).
Les tubes de la galerie sont ensuite incubés à 30C pendant 5 j. Les souches identifiées L. monocytogenes sont envoyées pour le sérotypage au C.N.R.L. (Centre National de Référence de Listeria , Paris).
3. Dénombrement de la flore lactique et de la flore de surface
Ce dénombrement se fait à partir de la dilution de base par un système de dilutions décimales, avec ensemencement sur des milieux gélosés sélectifs.
Flore lactique
Genre Lactobacillus : dénombrement sur milieu MRS (de Man, Rogosa et Sharpe), avec incubation 72 h à 30C (de Man et al., 1960).
Genre Streptococcus : dénombrement sur milieu M17, avec incubation 72 h à 30C (Terzaghi et Sandine, 1975).
Levures et moisissures
Il s'agit de la méthode AFNOR (Anon., 1988) : le dénombrement s'effectue sur milieu OGA (Oxytétracycline Gélose Agar), avec incubation 4 à 5 j à 25C.
Ferments du rouge
Leur dénombrement est réalisé sur milieu gélosé TSLA (Tryptone-Soja, extrait de Levures et Agar) (4% NaCl pds/v), avec incubation 7 j à la lumière du jour et à température ambiante (Jones et Ronald, 1986).
IV. Mesure du pH
La mesure du pH est effectuée à l'aide d'un pH-mètre de type Knick Microprozessor Calimatic. Un échantillon de 3 g de la croûte ou du coeur du fromage est prélevé et broyé dans 3 ml d'eau distillée. La mesure est faite dans l'homogénat obtenu.
V. Conditions du traitement ionisant
1. Ionisation
Tous les traitements sont effectués par des électrons accélérés à l'aide d'un accélérateur électrostatique de type Van de Graaff (voir schéma en annexe III) dont dispose le Critt AERIAL (Analyses, Etudes et Recherches pour l'Industrie Alimentaire) au sein de la société VIVIRAD située à Handschuheim (France). Le faisceau d'électrons utilisé a
une intensité de 50 µA et un débit de dose de 3,2 kGy/s.Les doses appliquées, dites doses à l'entrée, ne sont réellement reçues qu'en surface et varient suivant l'épaisseur du milieu traversé. Une hétérogénéité de distribution de dose de l'ordre de ± 30% par rapport à la dose moyenne est observée. Une fine plaque de cuivre ( 100 m) déposée à la surface du fromage permet de diminuer l'hétérogénéité de dépôt de dose à l'intérieur du fromage de Munster (Kuntz et al., 1991).
Les traitements sont combinés au froid (réfrigération à 4C) et le transport des échantillons est effectué dans des glacières réfrigérées.
2. Dosimétrie
Une mesure de la dose d'ionisation délivrée par l'accélérateur et appliquée à l'aliment peut être obtenue d'après les paramètres du faisceau d'électrons.
Pour la dosimétrie de routine des films radiachromiques (FWT 60-00, Goleta, USA), préalablement calibrés à l'aide d'un dosimètre à alanine par le Laboratoire de Mesure des Rayonnements Ionisants (Gif-sur-Yvette, France), sont utilisés. Ces films en nylon contiennent un colorant radiosensible (absorbance à 600 nm) et sont utilisables pour mesurer des doses de 0,5 à 15 kGy. La précision des mesures données par ces films, inférieure à 5%, peut encore être améliorée (2 à 3%) par mesure de leur épaisseur. La dose reçue est celle lue sur les dosimètres fixés sur les fromages au cours du traitement ionisant.
VI. Analyse sensorielle
1. Méthode
La méthode employée doit répondre à deux exigences : permettre à la fois de caractériser chacun des fromages ionisés (selon la dose reçue) et de les comparer entre eux et avec les témoins. Il est donc demandé à chaque dégustateur de remplir une fiche descriptive par échantillon (voir annexe IV). Les critères sensoriels choisis pour cette fiche sont ceux qui paraissent les plus significatifs pour décrire la qualité organoleptique d'un fromage de type Munster. Ils sont placés dans un ordre logique de consommation : critères de l'aspect, puis de l'odeur, de la texture et enfin du goût. Les critères "autre goût" et "autre odeur" sont intéressants dans la mesure où ils font appel essentiellement à la subjectivité des juges et que l'étude porte sur des produits ionisés (création possible de goûts ou d'odeurs atypiques). Le dernier critère de chacune des rubriques est un critère hédonique (qualité globale) : il s'agit d'une appréciation personnelle du juge. Les autres critères sont qualifiés d'analytiques : ils ne mesurent qu'un niveau d'intensité.
L'échelle utilisée est en 7 points, ce qui implique une assez grande précision pour la mesure de chaque descripteur. L'ensemble de ces fiches est ensuite traité informatiquement, séance par séance, puis globalement.
Une définition des principaux termes spécialisés utilisés est donnée en annexe V.
2. Jury
Le choix du jury s'est porté sur des consommateurs déjà initiés à l'analyse sensorielle, donc aptes à répondre à un questionnaire descriptif. Le recrutement s'est effectué à partir d'un fichier d'environ deux cents personnes sur la base de l'expérience des individus en matière d'analyse sensorielle, de leur habitude à consommer du fromage de Munster et de leur disponibilité. Quarante personnes ont été recrutées par journée de dégustation et retenues, dans la mesure du possible, pour l'ensemble du suivi. Au total, cinquante-sept personnes ont participé à l'expérience, dont près de la moitié à au moins trois séances.
Dans une deuxième étude, un jury d'experts est choisi. Les dégustateurs sont au nombre de 16 et sont des consommateurs réguliers sélectionnés et des professionnels (affineurs).
3. Organisation des dégustations
Les séances se déroulent dans une salle de dégustation pourvue de boxes individuels à cloisons amovibles, disposés circulairement. Chacun des boxes est équipé de son propre néon, d'où un éclairage homogène pour l'ensemble du jury.
Chaque dégustateur reçoit un seizième de fromage (soit 30 g environ) par séance et par dose, posé dans une assiette de carton glacé. Une présentation uniforme des quatre échantillons pour chacun des juges est ainsi assurée. Afin de respecter les conditions usuelles de consommation du fromage de Munster, les échantillons sont sortis du réfrigérateur et préparés 15 à 30 min avant la dégustation.
Chacun des échantillons est codé par un nombre de deux chiffres pris au hasard pour assurer son anonymat.
Un plan de dégustation est établi de telle sorte que chaque échantillon soit dégusté un même nombre de fois dans chacune des dispositions possibles par rapport aux autres échantillons, et autant de fois avant qu'après un échantillon donné. Cette précaution permet d'éviter toute influence du rang de dégustation. De l'eau, du pain et une pomme verte sont mis à la disposition des dégustateurs afin que ces derniers puissent se "rincer la bouche" entre deux échantillons. Des précisions sont données aux juges quant à la fiche de dégustation et au déroulement de l'épreuve, mais il n'est pas précisé que les produits sont ionisés, de manière à ne pas influencer leur jugement.
4. Traitement des données
La méthode de traitement statistique utilisée est descriptive (par opposition à une analyse décisionnelle). Au moyen d'un logiciel d'analyse de données (SPADN), une analyse des correspondances multiples
(ACM) est réalisée. Les caractéristiques essentielles de cette démarche sont les suivantes : prise en compte simultanée d'un ensemble de variables (juges, doses d'ionisation, etc.) et représentation graphique des produits (par exemple) dans un espace dont chaque dimension (ou axe factoriel) s'appuie sur plusieurs variables.Une caractérisation automatique est abordée par cette méthode, reposant sur le concept de valeur-test. Cette dernière constitue un indicateur normalisé mesurant l'écart entre deux moyennes pour un critère donné : celle d'un descripteur pour un produit (ou un juge...) et celle du même descripteur pour l'ensemble des produits (ou des juges...), tout en tenant compte de la variabilité autour de ces moyennes. Dans la pratique, plus une valeur-test est élevée, en valeur absolue, pour un critère et un produit (ou juge ou tout autre variable), plus ce critère caractérise le produit en question. L'avantage de cet indicateur est qu'il s'apprécie en référence à une échelle unique et permet des comparaisons entre variables ou même entre expériences différentes.
Résultats et discussion
I. Détermination de la DRD de L. monocytogenes
Le but de la détermination de la DRD relative à L. monocytogenes dans les fromages de Munster est de connaître la dose efficace à utiliser pour éliminer la bactérie en fonction du degré de contamination des échantillons. Par ailleurs, il est procédé à une comparaison entre les résultats obtenus dans le cas d'un traitement aux électrons accélérés et ceux préalablement obtenus dans le laboratoire après traitement aux rayons X.
L'étude porte sur des fromages de Munster au lait pasteurisé pris en fin d'affinage. Cinq échantillons sont analysés par dose d'ionisation et l'essai est répété trois fois. Au total, 80 échantillons sont analysés, aussi bien dans le cas d'une ionisation par rayons X que dans le cas d'une ionisation par électrons accélérés.
Tableau I
: Réduction de la contamination en L. monocytogenes 1/2c dans le fromage de Munster au lait pasteurisé en fonction la dose d'ionisation reçue. Comparaison du traitement aux électrons accélérés à un traitement aux rayons X*
*Les résultats concernant les rayons X ont été communiqués par V. Stahl (communication personnelle).
Les résultats du tableau I (voir aussi figure 1) montrent qu'il existe une relation linéaire entre la dose d'ionisation et la réduction du taux de contamination des fromages. Le calcul de la pente correspondante permet d'établir la DRD relative à L. monocytogenes dans le fromage de Munster. Celle-ci correspond à une dose de (0,49 ± 0,05) kGy en utilisant les électrons accélérés. Cette valeur est légèrement plus élevée que celle obtenue avec les rayons X (0,41 ± 0,03 kGy), ce qui pourrait être dû au fait que les effets secondaires de l'ionisation provoqués par la présence d'oxygène (augmentant la sensibilité des microorganismes) sont plus importants avec un rayonnement de faible débit de dose (rayons X : 0,5 kGy/h) qu'avec un rayonnement de fort débit de dose (électrons accélérés : 1 kGy/s).
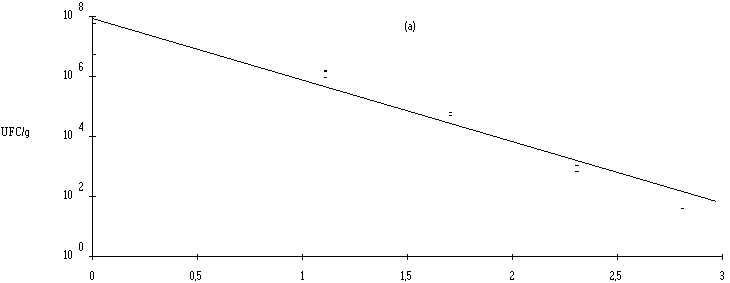
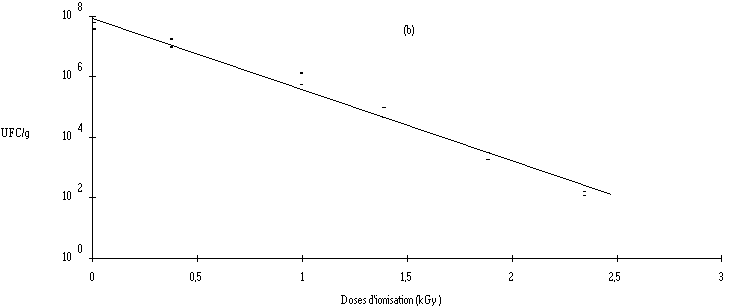
Figure 1
: Courbe de réduction de la population de L. monocytogenes dans le fromage de Munster en fonction de la dose d'ionisation par électrons accélérés (a) et par rayons X (b)Les DRD obtenues sont en bon accord avec celles obtenues dans les aliments carnés (voir p. 1) et montrent que L. monocytogenes est relativement radiosensible. Par conséquent, l'utilisation d'un tel traitement en vue d'éliminer cette bactérie est tout à fait envisageable. Néanmoins, l'estimation de la dose nécessaire pour éliminer L. monocytogenes dans les fromages de Munster requière la connaissance préalable des taux habituels de contamination de ce produit.
II. Etude de la contamination des fromages de Munster par L. monocytogenes
Les analyses microbiologiques portent sur les trois types de fromages de Munster étudiés, blancs (à l'état de caillé égoutté) ou affinés ; 94 fromages blancs (64 au lait pasteurisé, 15 au lait cru et 15 fermiers) et 546 échantillons affinés (357 au lait pasteurisé, 115 au lait cru et 74 fermiers) sont analysés.
1. Fréquence de la contamination
Sur l'ensemble des fromages blancs analysés (au lait cru, au lait pasteurisé et fermiers), aucune présence de L. monocytogenes n'est décelée (tableau II).
Tableau II
: Fréquence de la contamination naturelle en L. monocytogenes des fromages de Munster de fabrication industrielle (au lait cru ou au lait pasteurisé) ou de fabrication fermière
L. monocytogenes est par contre présente dans près de 60% des fromages de Munster affinés analysés (315 sur un total de 546 échantillons). Néanmoins, et bien que tous les fromages soient affinés dans les mêmes conditions, cette contamination est très variable suivant le type de fabrication (tableau II). En effet, les fromages de fabrication industrielle sont beaucoup plus contaminés que les fromages fermiers. Pourtant les fromages de Munster industriels, contrairement aux fromages de Munster fermiers, proviennent d'une fromagerie où une bonne hygiène est généralement respectée. Une explication de ce phénomène peut être avancée : le fromage de Munster fermier posséderait une flore compétitive vis-à-vis de L. monocytogenes et/ou productrice de substances inhibitrices, comme par exemple les bactériocines, empêchant ainsi L. monocytogenes de se développer.
2. Taux de contamination
D'après le tableau III, il apparaît que le taux de contamination en L. monocytogenes varie également de façon notable suivant que le fromage est de fabrication industrielle (au lait cru ou au lait pasteurisé) ou d'origine fermière. Ainsi, les fromages fermiers se démarquent nettement des fromages de fabrication industrielle en n'étant contaminés qu'à des concentrations inférieures ou égales à 104 UFC/g. De plus, sur les 19 fromages fermiers contaminés, 9 présentent des taux de contamination inférieurs à 102 UFC/g. Dans les fromages au lait cru de fabrication industrielle, les taux de contamination les plus fréquents se situent entre 104 et 105 UFC/g, mais ceux-ci peuvent être contaminés jusqu'à des teneurs comprises entre 106 et 107 UFC/g. Les fromages au lait pasteurisé sont quant à eux plus fréquemment contaminés à des concentrations comprises entre 102 et 104 UFC/g, et seule une faible proportion d'entre eux affiche des taux de 105 à 106 UFC/g. Ces résultats confirment bien ceux obtenus dans le paragraphe précédent et confortent l'hypothèse de la présence d'une flore antagoniste dans les fromages d'origine fermière.
Tableau III
: Taux de contamination par L. monocytogenes des fromages de Munster affinés
Alors que tous les fromages sont indemnes de L. monocytogenes à leur entrée en cave, les résultats obtenus (tableaux II et III) montrent également que les fromages au lait cru sont plus fréquemment contaminés que les fromages au lait pasteurisé et à des taux de contamination plus élevés. Les fromages au lait cru présenteraient-ils des conditions de croissance plus favorables à L. monocytogenes? Pourtant le lait pasteurisé garde tous les substrats dont une bactérie a besoin pour son développement. L'explication pourrait alors résider dans le fait que le fromage au lait cru contiendrait une flore originelle d'affinage (ferments du rouge et flore fongique) plus abondante que celle des fromages au lait pasteurisé, assurant une maturation plus rapide au cours de l'affinage, favorable au développement de L. monocytogenes (voir p. 23).
3. Origine de la contamination
Partant de la constatation que les fromages de Munster à l'état de blancs, même au lait cru, ne sont pas contaminés par L. monocytogenes, il semble donc que la contamination des fromages affinés provienne de l'environnement des caves d'affinage, et non d'une contamination originelle du lait de fabrication. La technique d'affinage des fromages de type Munster, qui nécessite des lavages successifs (voir annexe VI), serait à l'origine de la contamination par L. monocytogenes (Michard et al., 1989). Cette hypothèse est confortée par l'observation suivante : lors de l'étude de la contamination des fromages, une prépondérance des sérotypes 1/2a (50%) et 1/2b (38%) a été notée, ce qui indiquerait une origine commune de la contamination. Si on admettait une contamination originelle du lait cru, dont les voies de contamination sont très nombreuses (ensilage, trayons, tanks à lait,...) et les origines très diverses, les sérotypes devraient être beaucoup plus variés. La contamination constatée des fromages de Munster au lait pasteurisé est une preuve supplémentaire que la contamination des fromages ne provient pas du lait de fabrication.
III. La décontamination des fromages de Munster par traitement ionisant
Au vu des taux de contamination en L. monocytogenes les plus fréquemment rencontrés dans les fromages au lait pasteurisé (de 102 à 104 UFC/g) et dans les fromages au lait cru (de 104 à 105 UFC/g) et compte tenu des valeurs de DRD obtenues, des doses d'ionisation d'environ 2 à 2,5 kGy devront être utilisées en vue d'éliminer la bactérie pathogène dans ces fromages.
L'élimination de L. monocytogenes par traitement ionisant aux rayons X a déjà fait l'objet de travaux dans le laboratoire. L'ionisation, réalisée à une dose de 2,5 kGy sur toute l'épaisseur du fromage, a provoqué des modifications importantes et inacceptables de la qualité organoleptique de l'aliment (V. Stahl, communication personnelle). Afin de minimiser la dégradation organoleptique du produit, il est donc indispensable de pouvoir diminuer la dose d'ionisation absorbée. Or, en ionisant l'ensemble du fromage, cela n'est possible qu'en abaissant préalablement les teneurs en L. monocytogenes. L'expérience a montré cependant que les mesures d'hygiène visant à contrôler la contamination au niveau industriel sont le plus souvent infructueuses.
L'étude réalisée par Michard et al. (1989) sur un fromage à pâte molle et croûte lavée (Pont-l'Evêque) a montré une prédominance de la contamination par L. monocytogenes dans la partie superficielle du fromage, allant jusqu'à 107 UFC/g, alors que le coeur du fromage n'était contaminé qu'à des taux inférieurs à 102 UFC/g. Cette localisation superficielle de L. monocytogenes serait, selon Michard et al. (1989), plus le fait d'une contamination essentiellement superficielle que de conditions défavorables de croissance à l'intérieur de la pâte. Dans d'autres fromages à pâte molle tels que le fromage de Camembert (Ryser et Marth, 1987), le caciotta et l'italico (Massa et al., 1990), L. monocytogenes est également présente essentiellement dans la croûte. Dans le cas où une telle localisation de L. monocytogenes serait vérifiée dans le fromage de Munster, une ionisation superficielle, avec des électrons accélérés de faible énergie, peut être envisagée. Un tel traitement serait réalisé à la fin de la période d'affinage pour tenir compte des possibles recontaminations lors des lavages réalisés au cours de cette période, mais aussi pour permettre une évolution normale de la maturation des fromages (pas d'effet sur la croissance des flores d'affinage). L. monocytogenes pourrait alors être éliminée sans que la totalité du fromage soit soumise aux rayonnements ionisants. La dose reçue par l'ensemble du produit serait donc plus faible que dans le cas d'un traitement aux rayons X, ce qui aurait l'avantage de limiter les répercussions négatives du traitement sur les qualités organoleptiques et microbiologiques du fromage.
1. Localisation de L. monocytogenes dans les fromages de Munster
L'étude de la contamination des fromages de Munster par L. monocytogenes a montré que celle-ci ne provenait pas du lait de fabrication et serait donc d'origine externe, ce qui pourrait être à l'origine d'une localisation superficielle de la bactérie. De plus, les conditions de multiplication de L. monocytogenes sont a priori plus favorables dans la croûte que dans le coeur du fromage. En effet, la flore fongique et les ferments du rouge devraient assurer, au cours de l'affinage, une meilleure désacidification du caillé au niveau de la partie superficielle du fromage et donc des conditions de pH plus favorables à la croissance de la bactérie.
Cette partie de l'étude consiste donc à étudier l'ensemble des facteurs susceptibles de favoriser une localisation superficielle de L. monocytogenes au sein du fromage de Munster et à préciser cette localisation tout au long de l'affinage. L'analyse microbiologique est effectuée sur des lots de 5 fromages au lait cru ou au lait pasteurisé, à raison de 3 lots par semaine, et ce du début jusqu'à la fin de l'affinage.
1.1. Evolution des flores naturelles et du pH au cours de l'affinage du fromage
Au cours du processus d'affinage, des différences importantes dans l'évolution des valeurs de pH entre la croûte et le coeur du fromage sont constatées. En effet, alors que le pH à l'intérieur de la pâte reste quasiment stable, celui de la croûte augmente de façon régulière à mesure que la maturation des fromages progresse. Dans le cas des fromages au lait cru (figure 2), les valeurs du pH (mesurées après 4 j d'affinage) sont de 5,02 et 5,32, respectivement dans le coeur et dans la croûte . A l'issue de l'affinage, une valeur moyenne de 5,35 est obtenue à l'intérieur du fromage, tandis que le pH atteint 7,42 dans la partie superficielle. Dans le cas des fromages de Camembert, une différence dans l'évolution du pH au cours de l'affinage (pH plus élevé dans la croûte que dans le coeur) a déjà été mentionnée par Lenoir (1962a). Par contre, l'étude de Michard et al. (1989), portant sur un fromage à pâte molle et croûte lavée (Pont-l'Evêque), ne fait pas état d'écarts de pH importants entre la croûte et le coeur.
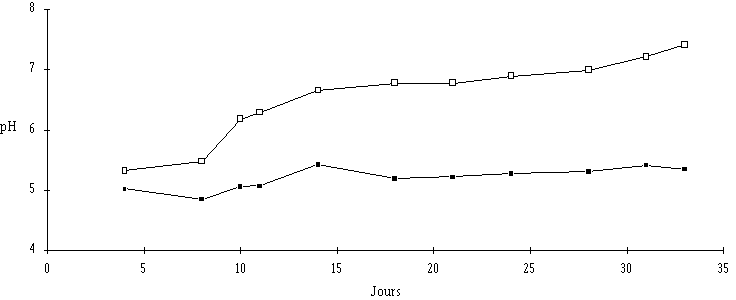
Figure 2
: Evolution du pH dans la croûte (Une disparité dans l'évolution du pH entre la croûte et le coeur résulte très vraisemblablement d'une croissance inégale des flores responsables de la maturation des fromages, essentiellement la flore fongique et les ferments du rouge. En effet, les levures, en plus de leur activité protéolytique et lipolytique, responsable de la production de molécules aromatiques ou de précurseurs d'arômes, sont à l'origine de la fermentation du lactose, limitant ainsi l'acidification lactique (Lenoir, 1984). Mais elles sont surtout capables de dégrader l'acide lactique du caillé, provoquant ainsi une augmentation du pH (Lenoir, 1984). Or, dans la partie superficielle des fromages au lait cru, la concentration de la flore fongique est de 108 UFC/g après 8 j de mise en cave et reste sensiblement inchangée jusqu'au terme de la période d'affinage (figure 3). Pour ce qui est du coeur du fromage, les teneurs en flore fongique dénombrées oscillent entre 103 et 104 UFC/g jusqu'à la fin de la maturation, ce qui signifie que leur action désacidifiante dans cette partie du fromage est très limitée comparativement à celle observée dans la croûte.
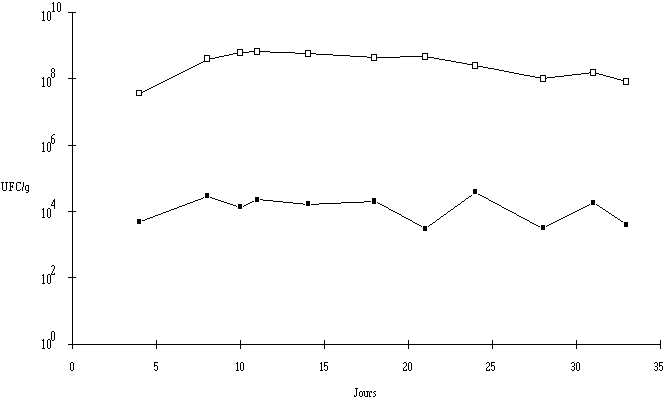
Figure 3
: Evolution des levures et des moisissures dans la croûte (La flore lactique, par contre, ne semble pas jouer de rôle important dans l'évolution du pH dans le coeur et la croûte du fromage de Munster. En effet, l'écart entre les concentrations de bactéries lactiques dans le coeur et dans la croûte est faible du début jusqu'à la fin de l'affinage (figure 4).
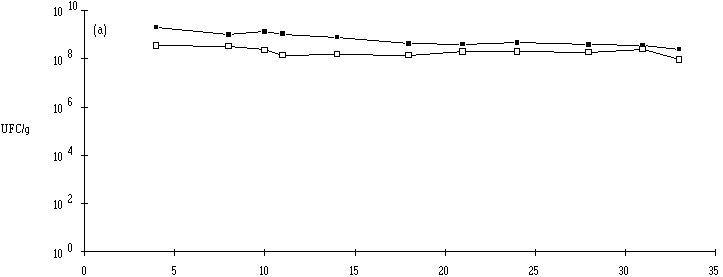

Figure 4
: Evolution de la flore lactique dans la croûte (Au niveau de la croûte, la remontée du pH, provoquée par le développement de la flore fongique, favorise la croissance de certaines bactéries acido-sensibles (Lenoir, 1984), telles que les ferments du rouge, composés principalement de corynébactéries et de microcoques. Cette flore, qui joue un rôle important dans le développement de l'arôme et surtout de l'aspect des fromages, est un bon indicateur du degré de leur affinage. La croûte des fromages au lait cru est marquée par un bon développement des ferments du rouge (figure 5). En effet, contrairement au coeur du fromage où cette flore ne dépasse pas des concentrations de 103 à 104 UFC/g, elle atteint dans la croûte des teneurs de 2.108 UFC/g après 14 j, puis 109 UFC/g au terme de l'affinage. L'évolution de cette flore est certes liée au pH, comme le montre l'augmentation simultanée du taux de bactéries pigmentées et du pH, mais également à son caractère aérobie qui limite sa multiplication à l'intérieur de la pâte (Lenoir, 1962b). Quatre espèces sont identifiées au cours de cette étude ; il s'agit de Brevibacterium linens (pigment orange), de Micrococcus sedendarius (pigment jaune), Arthrobacter sp. (pigment jaune) et de Staphylococcus xylosus (pigment orange). Dans les fromages à pâte molle et croûte lavée, B. linens est la bactérie ayant l'activité métabolique transformante la plus importante. Elle possède en effet une activité protéolytique qui peut dégrader jusqu'à 80% de la caséine disponible, avec notamment une production d'ammoniac, de composés volatils carbonylés, de dérivés soufrés et de phénols (Boyaval et Desmazeaud, 1983). Dans le cas particulier du fromage de Munster, l'association entre B. linens et les microcoques conduit à la production d'un thioester, le S-méthylthioacétate, qui contribue à l'arôme du fromage (Cuer et al., 1979).

Figure 5
: Evolution des ferments du rouge dans la croûte (L'évolution du pH, de la flore de surface et de la flore lactique dans les fromages de Munster au lait pasteurisé est tout à fait comparable à celle constatée dans les fromages de Munster au lait cru. Il faut néanmoins noter que l'augmentation du pH est plus rapide dans la croûte des fromages au lait cru que dans celle des fromages au lait pasteurisé pour lesquels une phase de latence d'environ 12 j est observée. Cela est sans doute dû à la charge microbienne en flore de surface initialement dénombrée, plus importante dans les fromages au lait cru que dans le cas des fromages au lait pasteurisé. En effet, la flore fongique initiale (après 4 j de mise en cave) est plus nombreuse de deux puissances décimales dans le cas des fromages au lait cru. Concernant les ferments du rouge, leur concentration dans la croûte des fromages au lait pasteurisé reste inférieure à 104 UFC/g, même après 12 j de mise en cave, alors que dans le cas des fromages au lait cru, elle est de 1,8.104 UFC/g après seulement 4 j d'affinage. Il apparaît ainsi que pour une même durée d'affinage, l'activité microbienne est plus importante et les processus biochimiques plus avancés dans le cas des fromages au lait cru que dans le cas des fromages au lait pasteurisé.
L'évolution de la flore lactique est quant à elle analogue dans les deux types de fromage. Une diminution d'un facteur 10 environ est constatée entre le début et la fin de la période d'affinage et la concentration de flore lactique est légèrement plus élevée à l'intérieur de la pâte que dans la partie superficielle.
1.2. Evolution de L. monocytogenes au cours de l'affinage du fromage
Les analyses effectuées sur la partie interne (profondeur > 6 mm) des fromages de Munster au lait cru n'ont révélé aucune contamination par L. monocytogenes pour des échantillons maintenus en cave jusqu'à la fin de leur période d'affinage (figure 6).
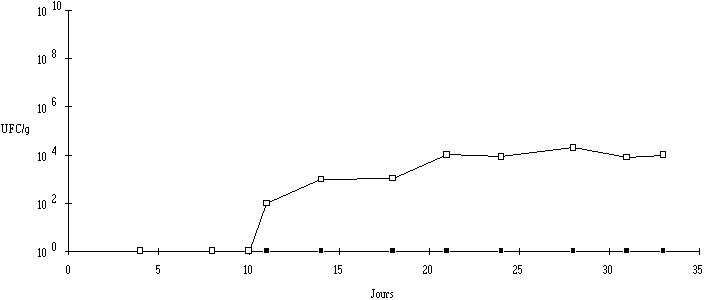
Figure 6
: Evolution de L. monocytogenes dans la croûte (Pour ce qui concerne la partie superficielle, il apparaît que la contamination est dépendante du stade d'affinage : dans les fromages au lait cru, la présence de L. monocytogenes est détectée à partir du 11ème jour d'affinage. Une croissance est ensuite constatée jusqu'au 21ème jour d'affinage, puis la population de L. monocytogenes se stabilise à environ 104 UFC/g jusqu'à la fin de la maturation. Cela montre que les conditions en surface sont favorables à la prolifération de L. monocytogenes.
Une différence est à noter concernant l'évolution de L. monocytogenes au niveau de la croûte entre les fromages au lait cru et les fromages au lait pasteurisé (figures 6 et 7). Dans ce dernier cas, l'apparition de la bactérie est plus tardive puisqu'elle n'a été décelée qu'après 17 j d'affinage. Le taux de L. monocytogenes augmente ensuite constamment pour atteindre 7,2.104 UFC/g au 28ème jour. Cette différence peut s'expliquer par une maturation plus rapide des fromages au lait cru, comme cela a été indiqué dans le paragraphe précédent. La charge microbienne initiale en flore fongique et en ferments du rouge, plus importante dans les fromages au lait cru que dans les fromages au lait pasteurisé, assure une désacidification du caillé plus rapide. La croissance de L. monocytogenes est donc plus rapide dans le cas des fromages au lait cru car le pH y est plus favorable. Pour les fromages au lait pasteurisé par contre, une phase de latence plus longue est observée, période pendant laquelle le pH et la concentration des ferments du rouge évoluent peu (résultats non présentés).
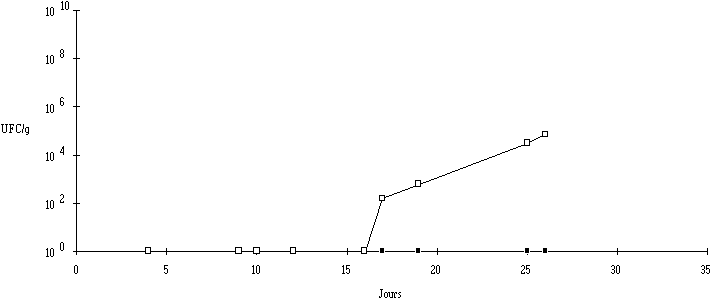
Figure 7
: Evolution de L. monocytogenes dans la croûte (L'absence de L. monocytogenes dans le coeur du fromage peut être interprétée de deux manières : une contamination superficielle des échantillons de fromage et des conditions écologiques défavorables à l'intérieur de la pâte.
Comme cela a déjà été mentionné (voir p. 17), l'absence de contamination par L. monocytogenes lorsque les fromages sont encore à l'état de blancs (entrée en caves) suppose que celle-ci a lieu pendant les lavages dans les caves d'affinage et doit donc être superficielle. Pour ce qui est de la deuxième hypothèse, le pH paraît être le facteur le plus à même d'empêcher l'extension de la contamination à l'intérieur du fromage. En effet, selon Seeliger (1961), L. monocytogenes se développe généralement dans une gamme de pH allant de 5,6 à 9,6. Or, à l'intérieur de la pâte, le pH ne dépasse pas 5,42 (fromage au lait cru) et 5,46 (fromage au lait pasteurisé), ce qui pourrait expliquer l'absence de contamination par L. monocytogenes dans la partie interne du fromage. Cependant, selon Conner et al. (1990), la croissance de L. monocytogenes ne serait inhibée qu'à une valeur du pH de 4,5 en présence d'acide lactique et une bonne multiplication du germe est constatée jusqu'à pH 5,0, valeur inférieure à celles enregistrées au niveau du coeur dans la deuxième moitié de la période d'affinage. Certains travaux révèlent même une croissance de L. monocytogenes à pH 4,5 (Parish et Higgins, 1989). D'autre part, Michard et al. (1989) ont réalisé une étude sur des fromages à pâte molle et croûte lavée de type Pont-l'Evêque affinés à coeur de sorte à obtenir des valeurs du pH de 6,4 à 8 à l'intérieur de la pâte et de 7,1 à 8,3 au niveau de la croûte. Les fromages n'étant pas initialement contaminés, ces auteurs ont constaté une contamination superficielle ne touchant pas le coeur du fromage alors que le pH y est pourtant favorable à la croissance de L. monocytogenes. En outre, les travaux de Ryser et Marth (1987) ont montré que dans des fromages à pâte molle fabriqués à partir de lait cru contaminé par L. monocytogenes, la concentration de cette bactérie dans le coeur était toujours inférieure d'une à deux puissances à celle existante dans la croûte, alors que le pH du coeur était optimal pour la multiplication de L. monocytogenes (pH 7 environ). Il semble donc que d'autres facteurs que le pH pourraient limiter la diffusion de la bactérie dans le coeur du fromage de Munster, comme par exemple l'anaérobiose partielle ou le fait que la contamination soit externe.
2. Traitement ionisant de surface aux électrons accélérés des fromages de Munster
La localisation superficielle de L. monocytogenes dans le fromage de Munster permet donc de n'envisager qu'un traitement ionisant en surface pour éliminer cette bactérie, par exemple en utilisant des électrons accélérés de faible énergie. Un tel traitement, réalisé en fin d'affinage à des doses de l'ordre de 2 à 3 kGy, pourrait en effet être efficace pour éliminer L. monocytogenes aux concentrations habituelles rencontrées dans les fromages de Munster, sans induire pour autant des modifications organoleptiques importantes, étant donné le faible volume de produit ionisé.
2.1. Conditions de traitement
Dans un traitement de surface aux électrons accélérés, un surdosage (amplification de la dose) est constaté dans les premiers millimètres de profondeur pour les faisceaux de faible énergie. La dose diminue ensuite progressivement jusqu'à s'annuler à une profondeur qui dépend de l'énergie des électrons accélérés. La conséquence d'un tel phénomène sera donc un traitement hétérogène du produit. Le surdosage peut être réduit en appliquant sur le produit à traiter une plaque en cuivre (Kuntz et al., 1991). Cette plaque (diffuseur) qui agit en absorbant une partie de l'énergie des électrons, permet d'obtenir une distribution de dose plus homogène à l'intérieur du produit (la figure 8 indique les courbes de distribution de doses dans l'eau) .
Figure 8
: Distribution de la dose d'ionisation aux électrons accélérés (énergie 2,2 MeV) en fonction de la profondeur d'eau, (a) sans diffuseur (dose à l'entrée 1 kGy) ; (b) avec diffuseur en cuivre de 100 m d'épaisseur (dose à l'entrée 1,5 kGy) (Kuntz et al., 1991)De l'énergie du faisceau d'électrons dépendent la profondeur du traitement et l'importance du surdosage, ce dernier pouvant varier également suivant l'épaisseur du diffuseur utilisé. Des mesures dosimétriques ont permis de suivre la distribution de la dose appliquée à l'intérieur du fromage. Deux conditions de traitement sont retenues :
-1,5 MeV avec un diffuseur en cuivre de 50 µm d'épaisseur : la pénétration, avec des doses absorbées supérieures ou égales à la dose délivrée, est de 2,8 mm ; au delà de cette profondeur, la dose absorbée diminue régulièrement et s'annule à 5,6 mm.
-2,2 MeV avec un diffuseur en cuivre de 100 µm d'épaisseur : la pénétration avec des doses absorbées supérieures ou égales à la dose délivrée est de 3,5 mm ; au delà de cette profondeur, la dose diminue régulièrement et s'annule à 8,5 mm (dans l'eau cette limite est légèrement supérieure (figure 8)).
L'épaisseur du diffuseur doit croître avec l'énergie des électrons utilisés pour que celui-ci soit efficace : un diffuseur de faible épaisseur (50 m) ne permet pas une bonne homogénéisation de la distribution de dose pour un rayonnement d'énergie 2,2 MeV, alors qu'un diffuseur plus épais (100 m) sera trop absorbant si l'énergie du rayonnement est faible (1,5 MeV), ce qui explique le choix des conditions de traitement.
L'étude porte sur des échantillons de fromage de Munster naturellement contaminés, au lait pasteurisé et ayant subi 27 j d'affinage. Pour chaque énergie, douze fromages sont soumis à trois doses d'ionisation différentes (tableau IV).
Bien que la contamination des fromages témoins soit importante (allant jusqu'à 3,2.105 UFC/g), les doses délivrées étant pour la plupart supérieures à la dose minimale théoriquement efficace (environ 5 fois la DRD : 2,2 à 2,7 kGy) exigée pour éliminer L. monocytogenes, elle n'est plus détectée après le traitement ionisant, même après entretien du bouillon d'enrichissement pendant 7 j. La dose minimale délivrée, qui est de 2,1 kGy, apparaît donc déjà suffisante pour éliminer L. monocytogenes, même à des concentrations de 3,2.105 UFC/g.
Tableau IV
: Effet du traitement ionisant aux électrons accélérés à différentes doses et énergies sur la contamination des fromages de Munster par L. monocytogenes
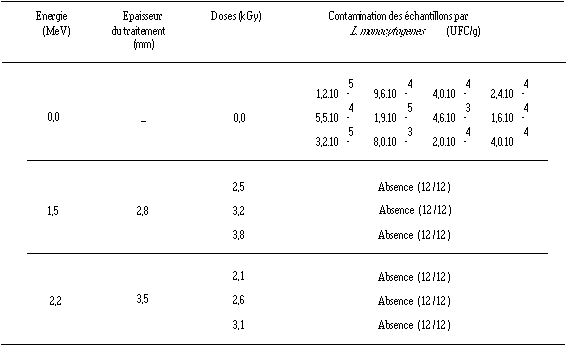
A une énergie de 2,2 MeV, le radiotraitement est réalisé sur 3,5 mm (diminution de la dose jusqu'à 8,5 mm) (figure 9). Une énergie de 1,5 MeV (traitement sur 2,8 mm, mais diminution de la dose jusqu'à 5,6 mm) est également testée dans le but de réduire le volume de fromage ionisé. Les doses délivrées aux deux énergies se sont révélées efficaces. Cet essai confirme la localisation très superficielle de L. monocytogenes dans les fromages de Munster et atteste de l'efficacité du traitement en surface aux électrons accélérés en vue de détruire L. monocytogenes.
Compte tenu des résultats dosimétriques qui révèlent une hétérogénéité de dose plus importante dans le cas d'une énergie de 1,5 MeV avec un diffuseur de 50 m (figure 9), une énergie de 2,2 MeV et un diffuseur d'une épaisseur de 100 m sont choisis pour la suite de l'étude.
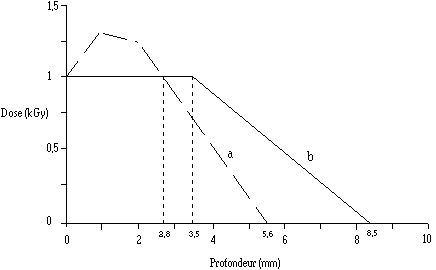
Figure 9
: Distribution de doses d'ionisation dans le fromage de Munster : (a) énergie de 1,5 MeV (diffuseur 50 m d'épaisseur) ; (b) énergie de 2,2 MeV (diffuseur 100 m d'épaisseur)2.2. Dispositif de traitement
Une des précautions prises lors de la réalisation de l'essai précédent fût d'enlever la tranche des fromages après ionisation afin d'éviter la contamination des zones traitées par L. monocytogenes. Un tel risque est un inconvénient majeur du traitement partiel des fromages. Il s'avère donc nécessaire d'étudier la réalisation technique du traitement de la totalité de la surface d'un échantillon de fromage. Ce traitement doit en effet comprendre les deux faces du produit ainsi que la tranche, et doit être le plus homogène possible.
Afin de répondre à ces deux exigences, un système de rétrodiffusion des électrons sur les tranches a été conçu. Les fromages sont placés dans une assiette métallique qui permet l'ionisation de la tranche par réflexion des électrons sur le bord du récipient. Un diffuseur en cuivre recouvre l'ensemble, permettant un dépôt homogène de la dose dans le produit (figure 10). Le bord du récipient forme un angle de 45 avec la tranche et permet d'y renvoyer une partie de la dose incidente. La dose que reçoit la tranche est fonction du métal utilisé comme assiette, c'est à dire de sa capacité à absorber les électrons incidents. L'inox (acier inoxydable) a été choisi pour cette étude car, d'après Seltzer et Berger (1974), il permettrait de réfléchir environ 50% de la dose reçue. Ceci devrait permettre dans un premier temps de traiter une face à 100% et la tranche à 50%, puis après retournement du fromage, de traiter la deuxième face et de compléter à 100% la dose sur la tranche.
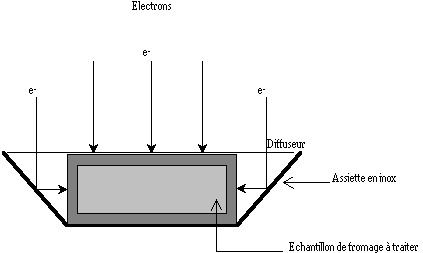
Figure 10
: Système de rétrodiffusion des électrons accélérés. Le traitement se fait en deux étapes : dépôt de 50% de la dose sur la tranche et de 100% sur une face, puis retournement des fromages pour compléter le traitement. (partie traitéeUn tel dispositif est donc utilisé pour réaliser le traitement ionisant de la totalité de la surface du fromage. L'étude porte sur des fromages de Munster naturellement contaminés pris en fin d'affinage. Les résultats figurent dans le tableau V.
Tableau V
: Efficacité du système de rétrodiffusion des électrons dans le traitement ionisant des fromages de Munster
Concernant les doses reçues, un surdosage d'environ 50% sur la tranche des fromages par rapport à la dose que reçoit la face est constaté, et ceci quelle que soit la dose d'ionisation. Ce résultat n'est pas en bon accord avec les résultats de l'étude de Seltzer et Berger (1974). Néanmoins, à condition qu'il n'ait pas d'incidences importantes sur la qualité organoleptique des fromages, ce surdosage sur la tranche ne constitue pas un inconvénient majeur.
3. Effets du traitement sur L. monocytogenes
Les fromages, naturellement contaminés, reçoivent des doses d'ionisation de 2,5 kGy sur les faces et 3,7 kGy sur la tranche (surdosage de 50%) et sont analysés 48 h après le traitement, puis tout au long de la période de stockage à 4C. Une analyse est effectuée tous les 7 j. Le suivi des fromages s'étend jusqu'à 44 j de conservation (la date limite de consommation (DLC)) des fromages de Munster est de 40 j). L'étude microbiologique est effectuée sur un total de 70 fromages au lait pasteurisé affinés constitué d'un lot témoin et d'un lot ionisé (35 échantillons par lot).
Les fromages témoins présentent des taux moyens de contamination en L. monocytogenes de 1,0.103 UFC/g et 4,0.102 UFC/g, respectivement sur la face et sur la tranche (figure 11). Cette différence, inférieure à une unité logarithmique, n'est pas significative, ce qui révèle une contamination relativement homogène de toute la surface des fromages.
Figure 11 :
Evolution de L. monocytogenes dans les fromages ionisés (faceThéoriquement, une dose de 3 fois la DRD (1,5 kGy environ) est suffisante pour éliminer L. monocytogenes présente à un taux de 103 UFC/g. Cependant, cette valeur correspond à une moyenne et certains échantillons peuvent être contaminés à des concentrations plus élevées. A cet égard, une dose de 2,5 kGy assure une marge de sécurité allant jusqu'à des taux éventuels de 105 UFC/ml (tableau IV). Dans les fromages ionisés, l'élimination de L. monocytogenes est effectivement totale, puisque 48 h après le traitement, ce germe n'est pas retrouvé, même après un enrichissement de 7 j. Ce résultat a été confirmé lors d'un deuxième essai (tableau VI).
L'étude au cours du stockage (figure 11) révèle que le taux moyen de contamination des fromages témoins en L. monocytogenes, qui est initialement de l'ordre de 1,0.103 UFC/g, se maintient sans grandes variations jusqu'à la fin de la période de conservation (44 j). Il n'y a pas de différences notables de contamination entre la face et la tranche. La population de L. monocytogenes n'évolue donc plus une fois l'affinage terminé, bien que le pH de la croûte soit favorable à sa multiplication. Cet arrêt de la croissance est vraisemblablement dû à la température de stockage (4C) et à la saturation de l'aliment en microflores variées et donc à l'épuisement de substrats assimilables.
Tableau VI
: Efficacité de différentes doses d'ionisation dans l'élimination de L. monocytogenes dans les fromages de Munster (2ème essai)
Pour ce qui est des fromages ionisés, aucune reprise du développement n'est constatée jusqu'à la fin des 44 j de stockage. Cela concerne aussi bien la face (2,5 kGy) que la tranche (3,7 kGy) du fromage. Ce résultat ne fait donc que confirmer l'efficacité du traitement ionisant en surface afin d'éliminer totalement L. monocytogenes dans les fromages de Munster. De plus, le système de rétrodiffusion des électrons accélérés mis au point semble avoir donné le résultat escompté, à savoir l'élimination de la bactérie sur la totalité du fromage (faces et tranche).
4. Evolution de la flore naturelle et des qualités organoleptiques des fromages de
Munster témoins et ionisés au cours du stockage.
Cette étude vise à déterminer les éventuels effets de l'ionisation en surface sur la qualité organoleptique du fromage de Munster et à voir si ces effets peuvent être mis en rapport avec une réduction de la flore naturelle, et particulièrement une réduction de la flore de surface.
La flore microbienne du fromage de Munster est constituée essentiellement de bactéries lactiques, présentes dans l'ensemble du fromage mais prédominantes dans le coeur, et de micro-organismes de surface (flore fongique et ferments du rouge (corynébactéries et microcoques)).
L'étude de l'effet de l'ionisation sur la flore lactique montre qu'une dose de 2,5 kGy ne provoque qu'une réduction d'une puissance décimale de la concentration de cette flore dans la croûte (de 108 à 107 UFC/g). Cette concentration reste stable par la suite, tout au long du stockage. Etant donné le faible volume de produit ionisé, la diminution globale de la concentration en bactéries lactiques résultant du traitement ionisant est donc très faible et ne devrait pas avoir d'influence sur les caractéristiques sensorielles du fromage, ce d'autant plus que les bactéries lactiques ne jouent qu'un rôle limité dans son évolution organoleptique. Le maintien après traitement ionisant, pour l'essentiel, de la flore lactique est un résultat intéressant, étant donné le rôle probiotique de cette flore (Bottazzi et Mercenier, 1994).
Les principales caractéristiques organoleptiques du fromage affiné sont en fait déterminées par les activités protéolytique, aromatique, texturante et gazogène de la flore de surface. Le développement et l'activité de cette flore ont lieu essentiellement pendant la période d'affinage, donc avant le traitement ionisant. Néanmoins, l'évolution des fromages durant la période de stockage peut être éventuellement perturbée par la destruction de la flore fongique (augmentation de l'acidité du goût) et des ferments du rouge (perte de la coloration caractéristique). Toutefois, il est certain que ces flores sont impliquées dans le développement d'autres caractéristiques sensorielles du fromage plus difficiles à mettre en rapport avec leur activité métabolique.
Deux séries d'analyses sensorielles sont donc organisées, la première avec un jury de 16 dégustateurs composés de consommateurs réguliers (et sélectionnés) de fromages de Munster et d'affineurs a lieu 5 j après ionisation, la deuxième, visant à suivre l'évolution des fromages au cours du stockage, comporte des analyses effectuées 1, 10, 20 et 30 j après ionisation avec un jury composé de 40 consommateurs réguliers de fromages de Munster. Ces analyses ont pour but d'étudier les éventuelles conséquences de la destruction de la flore de surface sur les critères mentionnés (acidité du goût, couleur), mais aussi, plus généralement, d'apprécier les autres effets de l'ionisation (altération des protéines et des lipides) sur la qualité organoleptique du fromage de Munster (voir liste des critères sensoriels étudiés en annexe IV).
4.1. Flore fongique et acidité du goût
Les fromages de Munster témoins présentent une concentration moyenne de flore fongique dans la croûte de 8,2.106 UFC/g (2,9.107 au niveau de la tranche). Après traitement ionisant à 2,5 kGy (3,7 kGy au niveau de la tranche), une réduction de cette flore de près de 3 unités logarithmiques est observée (3,5.104 UFC/g dans la croûte et 1,1.104 UFC/g sur la tranche).
Lors du stockage après affinage (et éventuellement traitement ionisant) une légère diminution de la concentration de la flore fongique est observée, aussi bien dans la croûte des fromages témoins que dans celle des fromages ionisés (1 unité logarithmique après 30 j de stockage). Cette concentration continue de baisser par la suite dans les fromages témoins, alors qu'elle augmente dans la croûte des fromages ionisés, du moins au niveau de la tranche (la diminution observée au niveau de la face résulte vraisemblablement de l'empilement malencontreux des fromages dans leur emballage lors du stockage et de la création de conditions d'anaérobiose partielle au niveau de la face). En fin de stockage (44 j), l'écart n'est plus que d'une unité logarithmique environ (figure 12).
Figure 12
: Evolution de la flore fongique dans la croûte des fromages ionisés (faceApparemment, après traitement ionisant, la diminution de la teneur en flore fongique (à rôle alcalinisant) n'a pas de conséquences sur l'acidité du goût. Aucune différence concernant la qualité de goût n'est en effet notée par le jury de dégustation juste après ionisation entre les échantillons témoins et les échantillons ionisés (tableau VII, qualité du goût), puis lors du stockage.
Tableau VII
: Evaluation des fromages de Munster, en fonction des doses d'ionisation, par la qualité du goût et l'appréciation globale. La séance de dégustation est organisée 5 j après ionisation
4.2. Ferments du rouge et couleur de la croûte
Au terme de l'affinage, la concentration des ferments du rouge, aussi bien sur la face que sur la tranche du fromage est de 108 UFC/g. Elle diminue légèrement au cours du stockage dans les fromages témoins (environ 1 unité logarithmique après 44 j), vraisemblablement du fait d'une saturation microbienne progressive du produit au cours du stockage (figure 13).
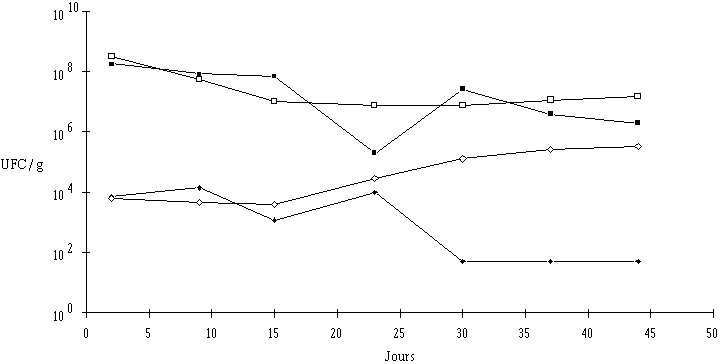
Figure 13
: Evolution des ferments du rouge dans les fromages ionisés (faceLe traitement ionisant entraîne une très forte baisse du nombre de bactéries pigmentées (il n'en reste que 103 à 104 UFC/g, 2 j après ionisation à la dose de 2,5 kGy). Ce taux reste sensiblement constant durant les 15 premiers jours stockage. Par la suite, une croissance du nombre de bactéries pigmentées est observée sur la tranche. Cette reprise de croissance, vraisemblablement due à une moindre concentration microbienne à la suite du traitement ionisant que celle notée sur les fromages témoins, ne s'observe pas sur la face, puisque la concentration en bactéries pigmentées chute brutalement pour s'établir aux environs de 101 UFC/g. Cela est dû sans aucun doute à des raisons analogues à celles expliquant la diminution de la flore fongique sur la face au cours du stockage (voir § 4.1, p. 31), c'est à dire un état d'anaérobiose partielle sur la face du fait de l'empilement des fromages lors du stockage. En effet, lors d'un deuxième essai au cours duquel une aération adéquate des fromages est assurée, ce résultat surprenant n'est pas observé : le nombre de germe est même plus important sur la face que sur la tranche, ce qui est normal dans la mesure où la dose d'ionisation reçue au niveau de la face est plus élevée que celle reçue au niveau de la tranche.
La diminution de la concentration en bactéries pigmentées après traitement ionisant a très certainement une incidence sur la couleur de la croûte des fromages. Ce critère sensoriel est en effet celui qui permet le mieux au jury de dégustation de différencier les fromages de Munster témoins et ionisés. Alors que les fromages témoins sont caractérisés par une couleur rouge tout au long du stockage, les fromages ionisés le sont par une couleur jaune, de plus en plus marquée et nette après 20 j de stockage. Parallèlement, la notation de la couleur des fromages ionisés par le jury est moins bonne que celle des fromages témoins et diminue au cours du stockage (tableau VIII), alors que celle des fromages témoins reste stable.
Tableau VIII
: Evaluation des fromages de Munster témoins et ionisés à 3 kGy, par la couleur de la croûte et l'appréciation globale, au cours du stockage à 4C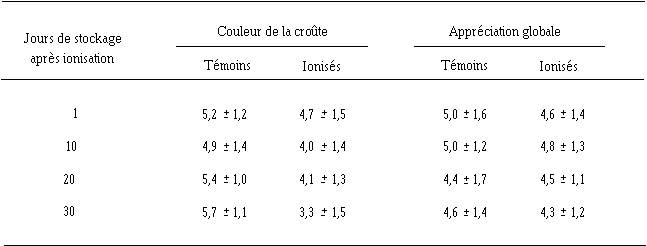
Vraisemblablement, l'ionisation doit plus affecter les souches pigmentées en orange (B. linens et St. xylosus) que celles pigmentées en jaune (Arthrobacter sp. et M. sedentarius). La reprise de croissance des ferments du rouge, observée après 23 j de stockage au niveau de la tranche, ne doit concerner que cette dernière catégorie, car le jaunissement de la tranche est de plus en plus marqué.
4.3. Effets de l'ionisation sur les autres critères sensoriels. Appréciation globale des
fromages de Munster
En plus de son action sur la flore microbienne, le traitement ionisant peut induire des modifications mineures des protéines et lipides du fromage, suffisamment importantes néanmoins pour provoquer des altérations organoleptiques, bien que seule une fraction réduite du fromage soit effectivement soumise au rayonnement ionisant.
En fait, selon le jury de dégustation, aucun des critères sensoriels figurant dans la fiche descriptive (voir annexe IV) ne permet réellement de différencier les fromages témoins et ionisés. Aucune modification du goût, de l'odeur et de la texture n'est observée après traitement ionisant, même à la dose de 3 kGy. Seul un léger jaunissement (voir § 4.2, p. 33) est mis en évidence par le jury. L'appréciation globale est la même pour tous les échantillons témoins et les échantillons ionisés (tableau VII).
Au cours du stockage, aucune évolution de l'appréciation globale n'est notée et rien ne permet de distinguer les fromages témoins et les fromages ionisés (tableau VIII), si ce n'est la couleur (jaunissement).
Conclusion
La surface du fromage de Munster, fromage à pâte molle et croûte lavée, semble être un milieu propice au développement de L. monocytogenes, contrairement au coeur du fromage qui est totalement exempt de la bactérie. Cette contamination provient exclusivement des caves d'affinage par l'intermédiaire des lavages pratiqués. Le pH de la pâte, bien que plus acide dans le coeur que dans la croûte, en raison d'un meilleur développement des flores d'affinage dans la partie superficielle, ne semble pas être le seul facteur pouvant intervenir dans cette localisation.
Le traitement ionisant des fromages de Munster en surface (aux électrons accélérés) en vue d'éliminer L. monocytogenes s'avère très efficace. La valeur de DRD obtenue dans le fromage est d'environ 0,5 kGy, ce qui assure, compte tenu des concentrations de L. monocytogenes habituellement rencontrées, une décontamination du produit à des doses relativement faibles (maximum 2,5 kGy). Les rayonnements ionisants de faible énergie (1,5 MeV) se révèlent tout aussi efficaces que les rayonnements d'énergie plus élevée (2,2 MeV), ce qui confirme la localisation très superficielle de L. monocytogenes.
Le traitement ionisant semble présenter l'intérêt d'assurer l'assainissement du fromage contaminé sans induire de changements dans les caractères organoleptiques de celui-ci. En effet aucun rejet des produits ionisés n'a été constaté et la distinction entre les produits témoins et les produits ionisés est difficile à faire. Seul un jaunissement, de peu d'importance sur le plan organoleptique, permet de différencier les deux types de fromages.
Le traitement par les électrons accélérés des fromages de Munster en surface en vue d'éliminer L. monocytogenes semble très prometteur. Associé à une politique de qualité mise en oeuvre au sein des usines, il peut constituer un moyen sûr de garantir l'absence de L. monocytogenes dans ce type d'aliment.