

Purification de la brévicine 9296, établissement de sa structure et localisation de ses déterminants génétiques
Introduction
Il a été montré dans les chapitres précédents que la souche Lb. brevis DSM 9296, isolée du fromage de Munster, produisait une bactériocine, la brévicine 9296, présentant une activité anti-Listeria très importante. L'ensemencement de cette souche à la surface du fromage, en début d'affinage, permet en effet d'empêcher le développement ultérieur de L. monocytogenes (traitement préventif). L'application directe de cette bactériocine, lors du lavage du fromage, permet aussi l'élimination de L. monocytogenes, lorsque celle-ci s'est déjà installée dans la croûte (traitement curatif). Pour la réalisation de ce deuxième traitement, il est bien sûr nécessaire de disposer de la bactériocine purifiée, et non simplement d'un extrait de culture. L'obtention d'une telle bactériocine devrait permettre non seulement le traitement anti-Listeria des fromages de Munster, mais également celui d'autres aliments sensibles à la contamination par cette bactérie, ce qui n'est pas forcément le cas lors d'un ensemencement de la souche productrice, qui peut ne pas être adaptée à un nouvel aliment (manque d'efficacité, perturbations organoleptiques). Mais avant d'envisager de tels développements des applications, il faut tout d'abord s'assurer que la brévicine 9296 est bien une nouvelle bactériocine. A priori, elle se différencie sans ambiguïté des autres bactériocines produites par les lactobacilles (voir p. 58). Il apparaît néanmoins nécessaire d'établir sa structure chimique. C'est l'objet de l'étude développée dans ce chapitre.
Matériel et méthodes
I. Souches bactériennes
La purification de la bactériocine est réalisée à partir de l'extrait de culture de Lb. brevis DSM 9296, souche préalablement isolée du fromage de Munster.
P. acidilactici H, producteur de pédiocine AcH, a été fourni par le Dr. Kalchayanand, University of Wyoming, Laramie, USA.
P. pentosaceus ATCC 25744 est utilisé comme marqueur de poids moléculaire des plasmides.
II. Purification des bactériocines
La purification des bactériocines se fait suivant le protocole établi par Nissen-Meyer et al. (1992).
Une culture de la bactérie productrice de bactériocine est réalisée dans un bouillon MRS (2 litres) à 37C pendant 18 h. Les cellules bactériennes sont éliminées par centrifugation à 2700 g pendant 10 min à 4C et les surnageants récupérés sont filtrés sur de l'acétate de cellulose 0,45 m (Sartorius).
1. Précipitation des protéines par le sulfate d'ammonium
La précipitation des protéines du filtrat obtenu se fait pendant une nuit à 0C en présence de 400g/l de sulfate d'ammonium (NH4)2SO4 (Merck). Le précipité est récupéré par centrifugation à 11000 g pendant 1 h à 4C, puis solubilisé dans 250 ml d'un tampon de phosphate de sodium 20 mM à pH 5,7 (tampon A). La solution obtenue est appelée fraction I.
2. Purification par passage sur un échangeur de cations
La fraction I, additionnée de 0,1% (v/v) de tween 80, est passée avec un débit rapide (5 ml/min) sur une colonne à échangeur de cations (S-Sépharose, Sigma) de 7 ml équilibrée avec le tampon A. Après lavage de la colonne (20 ml de tampon A), les molécules de bactériocine sont éluées par 40 ml d'une solution de chlorure de sodium 1M dans le tampon A. L'éluat obtenu est appelé fraction II.
3. Purification par passage sur une phase stationnaire inverse
La fraction II est additionnée de sulfate d'ammonium (100 g/l), puis passée, avec un débit de 4 ml/min, sur une colonne d'octyl-Sépharose (CL-4B, Sigma) d'un volume de 2 ml, équilibrée avec du tampon A contenant 10% de sulfate d'ammonium (pds/vol) (pH 5,7). Après lavage de la colonne avec 10 ml de tampon A, les molécules de bactériocine sont éluées avec 8 ml d'un mélange de tampon A et d'éthanol (30:70 v/v) à pH 5,7. L'éluat obtenu est appelé fraction III.
4. Isolement de la bactériocine par chromatographie en phase inverse (phase
stationnaire C2/C18)
La fraction III est diluée jusqu'à 50 ml avec de l'eau contenant 0,1% d'acide trifluoroacétique (vol/vol) et passée sur une colonne en phase inverse C2/C18 (PepRPC HR 5/5, Pharmacia-LKB) montée sur une chaîne CLHP (Waters, Millipore) à basse pression, équilibrée avec un mélange eau/isopropanol (90:10 v/v) contenant 0,1% d'acide trifluoroacétique. Les molécules de bactériocine sont éluées avec un gradient (pompe: Waters 600E, Millipore) de phase mobile eau-d'isopropanol (de 0 à 5 min : 90:10 v/v ; de 5 à 45 min : gradient linéaire de 90:10 v/v à 60:40 v/v, lors de la séparation initiale et de 0 à 5 min : 90:10 v/v ; de 5 à 15 min : de 90:10 v/v à 75:25 v/v ; de 15 à 55 min : de 75:25 v/v à 60:40 v/v, lors de la purification) contenant 0,1% d'acide trifluoroacétique, avec un débit de 1 ml/min. Un détecteur UV (Waters 991, Millipore) permet de suivre le profil d'élution des molécules de bactériocine à 280 nm. Des fractions de 1 ml sont recueillies par un collecteur de fractions (Cygnet, Roucaire) placé à la sortie du détecteur. Celles correspondant au pic de la bactériocine sont diluées 4 à 5 fois avec de l'eau contenant 0,1% d'acide trifluoroacétique, puis repassée sur la colonne C2/C18. La pureté de la bactériocine est contrôlée par spectrométrie de masse. La bactériocine purifiée (fraction IV) est stockée à -20C dans un mélange d'eau et d'isopropanol (50:50 v/v) contenant 0,1% d'acide trifluoroacétique.
Après chaque étape de purification, une mesure de l'activité des bactériocines par titrage selon la méthode de Mayr-Harting et al. (1972) (voir p. 43), ainsi qu'un spectre d'absorbance UV (spectrophotomètre : Uvikon 930, Kontron Instruments) sont réalisés.
III. Séquence d'acides aminés
Le poids moléculaire de l'échantillon purifié est déterminé par spectrométrie de masse avec ionisation Electrospray (ES-MS), couplée à un analyseur quadrupolaire (Bio-Q, VG Instruments (Manchester, UK)).
Le séquençage est réalisé par la dégradation d'Edman en mode liquide pulsé, sur un séquenceur de protéines (ABI, modèle 473A).
Dans certains cas, une hydrolyse enzymatique de la bactériocine (par l'endoprotéinase Lys-C) est nécessaire. L'hydrolysat du peptide est alors analysé par CLHP en phase inverse C18 (Macherey-Nagel) couplée à la spectrométrie de masse. Les fragments séparés sont ensuite séquencés un par un.
Toutes les manipulations ont été réalisées dans le Laboratoire de Spectrométrie de Masse Bioorganique (LSMBO) de l'URA 31 du CNRS (Strasbourg, France), dirigé par le Dr. A.Van Dorsselaer.
IV. Localisation des déterminants génétiques de production et d'immunité
Dans le but d'obtenir des souches mutantes non productrices de bactériocines (bac-), la souche bactériocinogène est ensemencée à 102-103 UFC/ml dans un bouillon MRS contenant des concentrations variables de novobiocine (0,01 ; 0,05 ; 0,25 ; 0,50 ; 1,00 et 5,00 g/ml), de mitomycine C (0,010 ; 0,025 ; 0,050 ; 0,250 ; 0,500 et 1,000 g/ml), d'acriflavine (25 ; 30 ; 35 et 40 g/ml) et de bromure d'éthidium (15 ; 20 ; 25 et 30 g/ml). Après une durée d'incubation comprise entre 18 et 48 h à 37C, suivant l'agent mutagène et sa concentration, les bouillons présentant une croissance sont étalés, après dilution, sur une gélose MRS et incubés pendant 18 à 24 h à 37C.
Les bactéries isolées sont testées pour leur activité antagoniste vis-à-vis de L. monocytogenes par la méthode de détection directe de Barefoot et Klaenhammer (1983) et la méthode des puits de Tagg et McGiven (1971), modifiées déjà décrites auparavant (voir p. 43). Les souches purifiées ne manifestant pas d'antagonisme vis-à-vis de L. monocytogenes par cette dernière méthode sont conservées dans les conditions déjà décrites (voir p. 42).
L'extraction de l'ADN et la détermination des profils plasmidiques sont réalisées suivant la méthode d'Anderson et McKay (1983), avec des modifications concernant les conditions de culture des souches (milieu et température différents), d'extraction (ajout d'une étape d'hydrolyse par une RNase) et de migration sur le gel d'agarose (temps et voltage différents) :
Les souches bactériennes sont cultivées dans un bouillon MRS à 37C pendant 18 h. Elles sont ensuite repiquées à 105-106 UFC/ml dans 40 ml d'un bouillon Elliker (Elliker et al., 1956) modifié appelé bouillon de lyse (Klaenhammer et al., 1978) et incubées à 37C pendant 4 h. La culture est alors centrifugée à 2700 g pendant 10 min et le culot bactérien utilisé immédiatement pour l'extraction de l'ADN. Le protocole d'extraction est détaillé dans le tableau XXVI.
La solution d'ADN (40 l) est mélangée à une solution de dépôt dans un rapport 10/1 (bleu de bromophénol 0,5% ; EDTA (acide éthylènediaminetétraacétique) 10 mM ; SDS (dodécyl sulfate de sodium) 3% ; glycérol 50%, dans l'eau) avant d'être déposée dans les puits du gel (0,6% d'agarose). La solution de dépôt, en augmentant la densité de l'échantillon, permet un meilleur dépôt de l'ADN au fond des puits. L'électrophorèse est réalisée dans un tampon Tris acétate contenant 40 mM de Tris, 20 mM d'acétate de sodium et 2 mM d'EDTA (pH 8,1). La migration de l'ADN se fait à 70V (2,8 V/cm) pendant 14 h et à 14C grâce à une circulation permanente d'eau froide dans laquelle est plongée la cuve contenant le gel. Une circulation du tampon électrophorétique est également assurée de façon à éviter la création par électrolyse d'un gradient de pH. L'ADN est révélé par réaction avec le bromure d'éthidium (2 g/ml, pendant 20 min) et mesure de la fluorescence à 590 nm après excitation à 312 nm. Le gel est photographié à l'aide d'un appareil de marque Polaroïd et à travers un filtre orange (sélection de l'émission de fluorescence due au complexe ADN-bromure d'éthidium).
Tableau XXVI
: Protocole d'extraction de l'ADN bactérien selon Anderson et McKay (1983) (les étapes supplémentaires ou ayant fait l'objet d'une modification sont soulignées)
Résultats et discussion
I. Obtention de la brévicine 9296 pure
La technique de purification des bactériocines mise au point par Nissen-Meyer et al. (1992) comporte 4 étapes successives :
- une précipitation de l'ensemble des protéines du milieu de culture par le sulfate d'ammonium,
- deux lavages successifs du précipité remis en solution dans un tampon phosphate, tout d'abord sur une colonne échangeuse de cations (S-sépharose), puis sur une colonne d'octyl-sépharose (phase inverse) (les bactériocines ayant généralement un pHi assez élevé (souvent > 10) et un caractère plutôt hydrophobe, sont fortement retenues sur chacune de ces colonnes).
- un isolement de la bactériocine par chromatographie en phase liquide basse pression (phase stationnaire C2/C18).
Cette dernière étape permet, par utilisation d'une phase mobile constituée d'un gradient eau-isopropanol contenant 0,1% d'acide trifluoroacétique, une séparation des molécules en fonction de leur hydrophobicité croissante. La mesure de l'absorbance à 280 nm indique la présence d'un pic majeur (figure 67) pour un temps d'élution de 30 min. Le titrage de l'activité anti-Listeria des différentes fractions de 1 ml recueillies montre clairement que le composé isolé est actif et correspond donc à la brévicine 9296 (le léger écart entre le pic d'activité et celui de l'absorbance serait simplement la conséquence d'un décalage entre la mesure du détecteur UV et la récupération des fractions pour le titrage de l'activité).
L'isolement n'étant pas tout à fait satisfaisant, les quatre fractions les plus actives, correspondant aux temps de rétention de 29, 30, 31, et 32 min sont mélangées, rediluées à 50 ml avec de l'eau contenant 0,1% d'acide trifluoroacétique et à nouveau chromatographiées. Un pic de brévicine 9296 très propre, correspondant à un temps de rétention de 21 min, est ainsi obtenu (figure 68). Les fractions 21 et 22, recueillies et mélangées, sont utilisées pour la suite de l'étude (étude de la structure de la brévicine 9296). Le spectre d'absorption UV obtenu, donné dans la figure 69, correspond à celui de résidus tryptophanes.
Figure 67 : Chromatographie en phase inverse (C2/C18) pour la purification de la brévicine 9296. Absorbance à 280 nm (![]() ), activité bactéricide (
), activité bactéricide (![]() ) et gradient d'isopropanol (
) et gradient d'isopropanol (![]() )
)
Figure 68 : Chromatographie en phase inverse (C2/C18) pour la purification de la brévicine 9296 (fractions 30, 31 et 32 de la figure 70 repassées). Absorbance à 280 nm (![]() ) et gradient d'isopropanol (
) et gradient d'isopropanol (![]() )
)
Figure 69
: Spectre d'absorption UV de la brévicine 9296La quantité de brévicine 9296 pure obtenue par la technique de Nissen-Meyer et al. (1992) est très largement supérieure à celle nécessaire pour réaliser toutes les études envisagées ultérieurement. Il faut néanmoins remarquer que le rendement global de la technique, apprécié par le rapport entre l'activité anti-Listeria totale (activité en UA/ml multipliée par le volume) de la fraction finale isolée par chromatographie (1,1.106 UA) et celle de l'extrait de culture initial (3,4.107 UA) est faible. Ces chiffres sont à comparer avec précaution dans le mesure où la brévicine 9296 ne se trouve pas dans un même milieu lors des deux mesures et que la nature du milieu peut influer sur l'activité anti-Listeria de la bactériocine. Mais plusieurs autres raisons peuvent expliquer le faible rendement obtenu. Tout d'abord, et cela a été fait volontairement, seule une partie des fractions constituant le pic chromatographique est à chaque fois récupérée au cours des deux séparations chromatographiques, afin d'être certain de n'obtenir en fin de compte que la bactériocine pure. Ensuite, il n'est pas du tout sûr que les conditions expérimentales utilisées au cours des deux premières étapes soient bien adaptées à la purification de la brévicine 9296. Apparemment, la précipitation de la bactériocine par le sulfate d'ammonium apparaît très incomplète, sans doute à cause de la précipitation d'une quantité importante de protéines autres que la bactériocine.
Une augmentation du rendement global de la technique passerait nécessairement par une modification du protocole analytique. Ce travail n'a pas été entrepris car l'objectif de la présente étude est simplement d'établir la structure chimique de la brévicine 9296 et donc d'obtenir d'abord la substance pure.
La bactériocine purifiée, en solution dans un mélange eau-isopropanol (50:50 v/v) contenant 0,1% d'acide trifluoroacétique (fraction IV) à -20C, est stable puisqu'après deux semaines de stockage dans ces conditions, aucune dégradation n'est observée (une chromatographie de cette solution n'indique aucun changement de l'aire du pic, ni aucune modification de l'allure du chromatogramme. Aucun changement d'activité anti-Listeria n'est noté).
II. Séquence d'acides aminés et structure chimique
L'étude de la fraction IV par spectrométrie de masse confirme la pureté de l'échantillon et révèle que le poids moléculaire de la brévicine 9296 est de (4623,60 ± Erreur! Source du renvoi introuvable.Erreur! Source du renvoi introuvable.Erreur! Source du renvoi introuvable. 0,15) Da.
Le passage de l'échantillon (fraction IV), soumis à la dégradation d'Edman, sur un séquenceur de protéines a permis d'obtenir la séquence de la brévicine 9296, qui est la suivante :
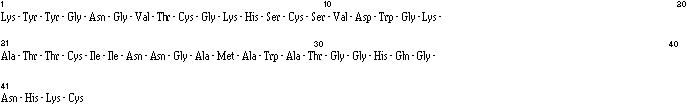
La différence entre le poids moléculaire mesuré et le poids moléculaire calculé (4628) suppose l'existence de deux ponts disulfures faisant intervenir les 4 cystéines de la séquence. Une hydrolyse enzymatique du peptide avec l'endoprotéinase Lys-C donne lieu à la formation de lysine (résidu 1) et de deux sous-unités dont le passage sur le séquenceur révèle la présence de deux extrémités N-terminales et donc d'une liaison disulfure par sous-unité. Les deux sous-unités ont la structure suivante :
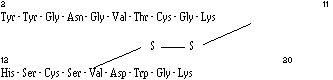
et
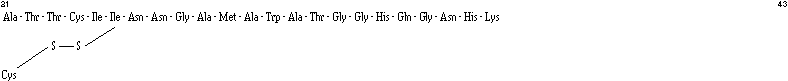
Il apparaît donc que les ponts disulfures se situent entre les cystéines 9 et 14 et entre les cystéines 24 et 44.
La structure de la brévicine 9296 est donc la suivante :
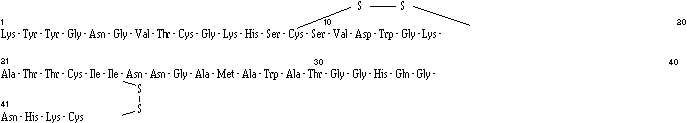
Le poids moléculaire calculé du peptide entier, en considérant l'existence de deux ponts disulfures, est de :
- 4624,2, si la fonction carboxylique de la cystéine C-terminale est libre ;
- 4623,2, si la fonction carboxylique de la cystéine C-terminale est amidée.
Le poids moléculaire mesuré étant de 4623,60 ± Erreur! Source du renvoi introuvable.Erreur! Source du renvoi introuvable. 0,15 Da, il apparaît plus vraisemblable que l'acide aminé C-terminal soit une amide. Cela devrait être néanmoins confirmé par une mesure de masse plus précise (sur une petite séquence) en réalisant une coupure enzymatique le plus près possible de l'acide aminé C-terminal.
La brévicine 9296 est donc un peptide de 44 résidus acides aminés. La présence de deux ponts disulfures dans une séquence de 44 acides aminés donne lieu à une structure relativement compacte et rigide, ce qui explique la résistance de la brévicine 9296 à la dénaturation par la chaleur.
D'après la classification des bactériocines admise actuellement (tableau XXVII), il apparaît que la brévicine 9296 fait partie de la sous classe IIa regroupant les bactériocines anti-Listeria sp. possédant dans la partie N-terminale la séquence caractéristique suivante : ![]() .
.
Tableau XXVII
: les différents types de bactériocines (d'après Klaenhammer (1993))
III. Comparaison avec d'autres bactériocines anti-Listeria
1. Comparaison des séquences d'acides aminés
Il apparaît que la séquence d'acides aminés de la brévicine 9296 correspond à celle de la pédiocine AcH produite par P. acidilactici H (Motlagh et al., 1992a), pour laquelle l'existence de ponts disulfures entre les résidus cystéines 9 et 14 d'une part et 24 et 44 d'autre part a également été décrite. Il a été montré par ailleurs que les bactériocines : pédiocine PA-1 (P. acidilactici PAC-1.0) (Henderson et al., 1992) et pédiocine SJ-1 (P. acidilactici SJ-1) (Schved et al., 1994b) sont également identiques à la pédiocine AcH et donc à la brévicine 9296. Toutefois, une incertitude persiste concernant la présence ou non d'une amide C-terminale, aussi bien pour la brévicine 9296 que pour les pédiocines.
Le fait que la brévicine 9296 ait la même structure que des pédiocines AcH, PA-1 et SJ-1 est intéressant dans la mesure où il s'agit du premier cas d'expression naturelle d'une même bactériocine chez des bactéries appartenant à des genres différents. Les seuls exemples connus de bactériocines identiques produites par des souches bactériennes lactiques différentes concernent en effet des bactéries de la même espèce : celui des pédiocines précitées (dont les souches productrices ont des profils plasmidiques différents (Schved et al., 1994b)) et de la lactococcine A, qui est synthétisée par Lc. lactis ssp. cremoris LMG 2130 (Holo et al., 1991), par Lc. lactis ssp. cremoris 9B4 (Van Belkum et al., 1991) et par Lc. lactis ssp. lactis biovar. diacetylactis WM4 (Stoddard et al., 1992) (les profils plasmidiques de ces dernières souches n'ont pas été comparés).
La figure 71 indique clairement une différence de forme entre la souche de Lb. brevis DSM 9296 (bacilles) et P. acidilactici H (cocci) et confirme sans ambiguïté la nature différente de ces deux souches. Une éventuelle contamination des cultures de Lb. brevis DSM 9296 par des pédiocoques est donc à écarter.
(a)
(b)
Figure 71
: Préparation de Gram de cellules bactériennes de (a) Lb. brevis DSM 9296 et de (b) P. acidilactici H2. Comparaison des déterminants génétiques de production de bactériocines
2.1. Localisation des déterminants génétiques de production de la brévicine 9296
Dans le but d'obtenir des souches mutantes non productrices de bactériocines (bac-), Lb. brevis DSM 9296 est ensemencé dans des tubes de bouillon MRS contenant des concentrations variables de novobiocine, de mitomycine C, d'acriflavine et de bromure d'éthidium. Une croissance de la bactérie est constatée dans tous les cas, mais des variants bac- (au nombre de 12) ne sont isolés qu'en présence de la novobiocine aux concentrations de 0,25 à 5 g/ml. Ces souches ont perdu le déterminant génétique responsable de la production de la brévicine 9296, mais sont de plus devenues sensibles (bacS) à l'action de cette bactériocine (diamètre de zone d'inhibition de 8 mm) et ont donc probablement perdu également celui codant pour une protéine responsable de l'immunité à la brévicine 9296. Le fait que la production de bactériocine et l'immunité de la bactérie productrice soient liées est souvent dû au fait que les gènes codant pour les deux caractères sont situés sur le même opéron (Van Belkum et al., 1991).
La détermination des profils plasmidiques (figure 72) de la souche d'origine Lb. brevis DSM 9296 et de ses variants bac- bacS, suivant la méthode modifiée
4 d'Anderson et McKay (1983), révèle qu'un seul plasmide manque chez tous les variants bac- bacS. Ce plasmide porterait donc le gène de structure de la brévicine 9296, ainsi qu'un gène responsable de l'immunité de la bactérie productrice vis-à-vis de la bactériocine. Ce plasmide est d'une taille de 11,0 kpb (figure 73).Ce résultat est conforme à ceux obtenus avec la plupart des souches bactériocinogènes dont les gènes de production de bactériocines sont également situés sur des plasmides (Nettles et Barefoot, 1993). Cependant, certaines bactériocines de lactobacilles peuvent être codées par des gènes situés sur le chromosome (ex : lactocine 27 (Lb. acidophilus LP27), helvéticine V-1829 (Lb. helveticus V-1829) et lactacine B (Lb. acidophilus N2)) (Nettles et Barefoot, 1993) ou sur un épisome (lactacine B (Lb. acidophilus 11088)) (Muriana et Klaenhammer, 1991).
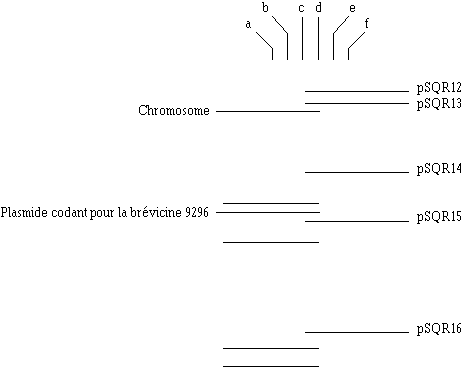
Figure 72
: Electrophorégramme sur gel d'agarose de l'ADN plasmidique de Lb. brevis DSM 9296 (e) et de ses variants bac- bacS (a, b, c, et d). Les plasmides du marqueur : P. pentosaceus ATCC 25744 (f) sont : pSQR12 (42,4 kpb) ; pSQR13 (28,8 kpb) ; pSQR14 (12,9 kpb) ; pSQR15 (9,1 kpb) et pSQR16 (3,5 kpb)
Figure 73 : Estimation du poids moléculaire du plasmide codant pour la production de la brévicine 9296, d'après la courbe étalon représentant le poids moléculaire en fonction de la distance de migration des plasmides de P. pentosaceus ATCC 25744
2.2. Comparaison des plasmides responsables de la production de la brévicine 9296 et de la pédiocine AcH
La taille du plasmide portant le gène de structure des pédiocines AcH, PA-1 et SJ-1 varie suivant la souche de P. acidilactici :
7,0 kpb dans le cas de P. acidilactici SJ-1 (Schved et al., 1993).
9,4 kpb (pSQR11) dans le cas de P. acidilactici PA-1 (Marugg et al., 1992)
8,9 kpb (pSMB74) dans le cas de P. acidilactici AcH (Motlagh et al., 1994)
La production d'une bactériocine commune n'est donc pas liée à un transport de plasmides conjugatifs entre ces trois souches de P. acidilactici ou entre celles-ci et Lb. brevis DSM 9296, étant donné que la taille du plasmide dans ce dernier cas est de 11 kpb. Toutefois, dans tous les cas, une perte ou une intégration d'un brin d'ADN peut très bien intervenir dans le plasmide après une conjugaison et donner lieu à une taille de plasmide différente. Il serait donc intéressant de déterminer le degré d'homologie entre les plasmides des pédiocoques d'une part et entre ces plasmides et celui de Lb. brevis DSM 9296, ce qui permettrait de voir si la (ou les) séquence(s) commune(s) se limitent uniquement au gène de structure de la bactériocine, à un opéron (regroupant les gènes de production, de maturation, d'immunité ou d'autres fonctions) ou si elle est plus étendue (jusqu'ici seule la séquence nucléotidique du plasmide pSMB74 est connue).
Une des différences possibles entre le plasmide codant pour le brévicine 9296 et le pSMB74 pourrait porter sur une séquence codant pour une enzyme de maturation, car les processus de maturation de la brévicine 9296 et de la pédiocine AcH semblent différents. En effet, aucune production de la pédiocine AcH n'est décelée à un pH final supérieur ou égal à 5,5, ce qui serait dû, selon Biswas et al. (1991), au fait qu'une réaction de maturation de cette bactériocine ne peut pas avoir lieu à un tel pH. Par contre, comme cela a été vu (voir p. 95), la production de la brévicine 9296 à un pH final de 7 est équivalente à celle mesurée à un pH final de 5. Dans le cas où, comme pour la pédiocine AcH, la maturation de la brévicine 9296 impliquerait une élimination protéolytique de la séquence leader d'un propeptide, il serait intéressant de voir si cette séquence, ainsi que l'enzyme responsable de cette hydrolyse sont identiques ou non dans les deux cas. Cela permettrait de comprendre pourquoi la production de bactériocine est dépendante du pH dans un cas et non dans l'autre.
Parmi les 3 plasmides codant pour la bactériocine chez les souches AcH, PA-1 et SJ-1 de P. acidilactici, seul le pSMB74 est associé avec l'immunité de la bactérie productrice (Ray et al., 1989) et partage donc cette propriété avec le plasmide codant pour production de la bactériocine chez Lb. brevis DSM 9296. Une comparaison entre les profils plasmidiques de ce dernier et de P. acidilactici AcH montre clairement que les plasmides codant pour la bactériocine sont de tailles différentes et confirme bien qu'il s'agit de deux souches différentes (figure 74).
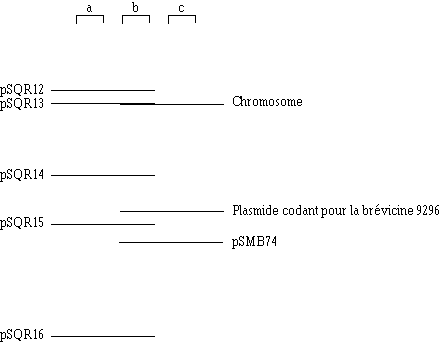
Figure 74
: Electrophorégramme sur gel d'agarose de l'ADN plasmidique de Lb. brevis DSM 9296 (b) et de P. acidilactici H (c). Les plasmides du marqueur : P. pentosaceus ATCC 25744 (a) sont : pSQR12 (42,4 kpb) ; pSQR13 (28,8 kpb) ; pSQR14 (12,9 kpb) ; pSQR15 (9,1 kpb) et pSQR16 (3,5 kpb)IV. Structure de la brévicine 9296 en relation avec son mode d'action
La connaissance de la séquence d'acides aminés de la brévicine 9296 est de nature à apporter des informations nouvelles concernant le fonctionnement et la relation structure - fonction de cette bactériocine. Cela, par exemple, peut aider à comprendre le mécanisme de la lyse cellulaire de la bactérie sensible provoquée par la brévicine 9296 (figures 15 et 16). Ainsi il apparaît que la brévicine 9296 présente une succession d'acides aminés polaires et d'acides aminés apolaires, qui pourrait donner lieu à une structure en hélice partiellement amphiphile, par exemple suivant le modèle proposé (figure 70), qui suppose que la région amphiphile (20 acides aminés : épaisseur de la membrane) se trouverait entre les résidus 8 et 28. Bien que la répartition des acides aminés ne soit pas parfaite, il faut noter que le remplacement d'un acide aminé par un autre de polarité opposée ne constitue pas une altération majeure du caractère amphiphile du peptide (Nissen-Meyer et al., 1992). De plus, dans la région apolaire, se trouvent deux acides aminés (sérine et glycine) dont les chaînes latérales sont faiblement polaires. La bactériocine pourrait donc agir en s'insérant dans la membrane de la bactérie sensible en structure oligomérique (côté apolaire des hélices dirigé vers les phospholipides en "Barrel-Stave" ou douves de tonneau) pour former des pores hydrophiles (canaux ioniques) qui permettraient la libération d'ions et de molécules de faible poids moléculaire, avec comme conséquence la suppression du potentiel membranaire, du gradient de pH et de la force motrice protonique (Nissen-Meyer et al., 1992 et 1993).
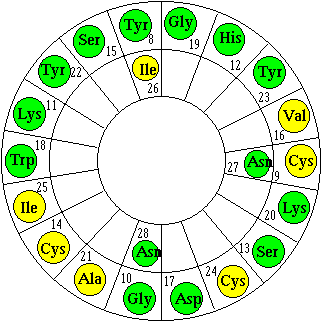
Figure 70 : Représentation en roue -hélicoïdale d'Edmundson d'un segment de la brévicine 9296 de 20 résidus possédant un caractère amphiphile. Cette région s'étend entre les résidus acides aminés 8 et 28. (![]() ) : résidus polaires, (
) : résidus polaires, (![]() ) : résidus apolaires
) : résidus apolaires
Ce résultat est en bon accord avec la plupart des études, qui indiquent que les bactériocines appartenant aux classes I et II (Klaenhammer, 1993) agissent sur la membrane plasmique (Zajdel et al., 1985 ; Gao et al., 1991 ; Van Belkum et al., 1991 ; Bruno et Montville, 1993 ; Venema et al., 1993 ; Abee et al., 1994).
Conclusion
La purification et le séquençage de la brévicine 9296 ont permis de constater que la séquence d'acides aminés de la brévicine 9296 correspond exactement à celle des pédiocines AcH, PA-1 et SJ-1 produites par P. acidilactici H, PAC-1.0 et SJ-1. Dans le cas où l'identité de Lb. brevis DSM 9296 est confirmée par comparaison avec une souche type de référence par hybridation ADN/ADN ou par détermination du profil des protéines cellulaires, il s'agirait du premier cas d'une bactériocine produite par des bactéries appartenant à deux espèces et deux genres différents.
Par ailleurs, il a été montré que les gènes de production de la brévicine 9296 et d'immunité de Lb. brevis DSM 9296 sont portés par un plasmide, de 11 kpb, différent (du moins en ce qui concerne la taille) du plasmide responsable de la production de la pédiocine AcH et de l'immunité de P. acidilactici H. Un simple transport de plasmide conjugatif entre les deux souches ne peut donc pas être envisagé, mais la possibilité d'une modification de plasmide après un tel transport n'est pas à exclure. Des différences constatées concernant la sensibilité de la production de bactériocine au pH entre Lb. brevis DSM et P. acidilactici H supposent que les systèmes enzymatiques de synthèse (notamment la maturation) et/ou de libération de la bactériocine seraient différents. L'isolement et le séquençage du plasmide codant pour la production de la brévicine 9296 permettrait, en comparant sa séquence avec celle déjà connue du plasmide responsable de la production de pédiocine AcH chez P. acidilactici H, de déterminer les degrés d'homologie et éventuellement des différences concernant par exemple la séquence leader, l'enzyme de maturation, etc...
Alors que l'utilisation de la brévicine 9296 purifiée dans les aliments ne présenterait pas d'intérêts nouveaux par rapport à la pédiocine AcH, l'utilisation de la souche productrice semble par contre être beaucoup plus intéressante dans le cas de Lb. brevis DSM 9296. En effet, étant donné que la production de bactériocine par P. acidilactici H est négligeable à un pH supérieur à 5 et nulle à un pH supérieur ou égal à 5,5, cette bactérie présente peu d'intérêt pour la lutte contre L. monocytogenes (et probablement d'autres flores pathogènes) dont le risque ne se manifeste généralement que dans des aliments dont le pH est proche de la neutralité. Aussi, l'utilisation de P. acidilactici H dans le fromage de Munster en cours d'affinage n'aurait donc sans doute pas donné des résultats aussi satisfaisants que ceux obtenus avec Lb. brevis DSM 9296 dont la production de bactériocine n'est pas affectée par le pH (de 5 à 7).
Le fait que la production de bactériocine par Lb. brevis DSM 9296 soit liée à un plasmide peut représenter un inconvénient pour ce qui est de l'utilisation de cette souche dans les aliments du fait de la faible stabilité des caractères plasmidiques. Toutefois, l'association des caractères de production et d'immunité chez Lb. brevis DSM 9296 signifie que les variants ayant perdu le plasmide responsable de la production de la bactériocine seront sensibles à l'action de la bactériocine présente et ne pourront sans doute pas se développer et s'imposer.
Par ailleurs, l'association du gène de structure de la brévicine 9296 à un plasmide offre la possibilité de transférer la capacité de production à des souches technologiquement intéressantes pour tel ou tel aliment, plus facilement que dans le cas où le déterminant génétique serait chromosomique.
La contamination des fromages de Munster par Listeria monocytogenes est fréquente (entre 26 et 79% environ) et peut dépasser 105 UFC/g. Elles n'est pas d'origine laitière, mais résulte des lavages répétés réalisés en cave au cours de l'affinage. L. monocytogenes est exclusivement localisée à la surface du fromage (à moins de 6 mm de profondeur), vraisemblablement parce que les conditions de pH et d'aérobiose ne sont pas favorables à son développement dans le coeur de l'aliment. Son apparition ne se produit jamais avant sept jours d'affinage. Le pH du fromage, relativement acide (4,7-5,0) lorsque celui-ci est à l'état de blanc, doit en effet légèrement augmenter (ce qui se produit au cours de l'affinage) pour que les conditions de développement de cette bactérie soient plus favorables (en fin d'affinage, c'est à dire 3 à 6 semaines, le pH de la croûte est généralement compris entre 6,5 et 7,5). Mais le pH n'est sans doute pas la seule cause pouvant expliquer cette apparition tardive de L. monocytogenes. Par ailleurs, l'étude de la contamination par L. monocytogenes de fromages de Munster différents (fermiers, industriels au lait cru et au lait pasteurisé) a permis de mettre en évidence, et cela a été très important pour le développement du travail réalisé, une contamination des fromages fermiers beaucoup moins fréquente et moins importante lorsqu'elle se produit que dans les fromages industriels.
Ces particularités de la contamination des fromages de Munster par L. monocytogenes ont permis d'envisager plusieurs méthodes pour obtenir des fromages totalement exempts de cette bactérie en fin d'affinage :
- l'ensemencement en début d'affinage, lors d'un lavage, d'une souche bactérienne productrice de bactériocine anti-Listeria, permettant ainsi d'empêcher l'apparition de cette bactérie pathogène,
- le traitement, éventuellement répété, par une bactériocine anti-Listeria (dissoute dans les eaux de lavage), entraînant la destruction de L. monocytogenes déjà présente dans le fromage et empêchant toute recontamination au cours des lavages,
- le traitement par les rayonnements ionisants des fromages emballés en fin d'affinage, dont l'objectif est de détruire l'ensemble des Listeria qui se sont développées lors de l'affinage.
Lorsqu'il est apparu que les fromages de Munster fermiers semblaient beaucoup mieux résister à la contamination par L. monocytogenes que les fromages de Munster industriels, sans doute dû à la présence dans ces fromages fermiers de souches bactériocinogènes anti-Listeria, l'idée du traitement de l'ensemble des fromages par de telles souches s'est imposée. Celles-ci devraient en effet pouvoir s'y développer harmonieusement et ne pas y provoquer de modifications organoleptiques puisqu'elles existent naturellement dans certains de ces fromages.
Six souches bactériocinogènes à activité anti-Listeria ont effectivement été isolées dans des fromages de Munster fermiers. Il s'agit d'un lactobacille (Lb. brevis DSM 9296), de deux entérocoques (E. faecium 81 et E. faecalis 96) et de trois lactocoques (Lc. lactis 102, 99 et 53). L'étude de la production, de l'activité et de la stabilité des bactériocines produites en bouillon de culture, mais dans des conditions de pH et de température d'affinage du fromage de Munster, a permis de montrer que Lb. brevis DSM 9296 et E. faecium 81 étaient les souches qui présentaient le meilleur antagonisme vis-à-vis de L. monocytogenes. Les bactériocines produites (brévicine 9296 et entérocine 81) sont relativement stables et actives dans une large gamme de pH (4-8) et leur production ne dépend pas du pH du milieu (entre 5 et 7), ce qui n'est pas le cas des autres bactériocines.
L'ensemencement de Lb. brevis DSM 9296 et d'E. faecium 81 dans les fromages de Munster en début d'affinage a effectivement permis d'empêcher tout développement de L. monocytogenes lorsque cette bactérie est artificiellement ensemencée après 7 jours d'affinage. Un résultat identique a été obtenu après ensemencement de Lb. brevis DSM 9296 en début d'affinage dans le fromage de Munster naturellement contaminé par L. monocytogenes. Par contre, L. monocytogenes s'est développée normalement dans les fromages de Munster témoins atteignant parfois des concentrations de 105 UFC/g. Le développement des souches de Lb. brevis et d'E. faecium n'a eu par ailleurs aucune incidence fâcheuse sur le déroulement de l'affinage.
Un traitement direct par la bactériocine (brévicine 9296 ou entérocine 81), permettant de détruire L. monocytogenes après son installation, a également été envisagé. Des essai ont été réalisés en utilisant des extraits de culture de Lb. brevis DSM 9296 et d'E. faecium 81. Ces extraits ont été utilisés pour traiter, par la voie de lavage habituelle, des fromages de Munster qui venaient d'être contaminés par artificiellement par L. monocytogenes. Des résultats positifs (disparition des Listeria implantées et absence de recontamination) ont été obtenus avec l'extrait de culture de Lb. brevis DSM 9296. Par contre, l'extrait de culture d'E. faecium 81 n'a pas empêché totalement le développement de L. monocytogenes, vraisemblablement parce que la quantité de bactériocine additionnée est insuffisante.
En fait, pour un tel traitement, il est nécessaire de pouvoir disposer de la bactériocine purifiée. Ce travail de purification a été pour le moment entrepris uniquement en ce qui concerne la brévicine 9296. Lors de l'établissement de la structure de cette molécule, il a été montré que celle-ci était tout à fait identique à la structure de la pédiocine AcH produite par P. acidilactici H, résultat très surprenant dans la mesure où les deux bactéries appartiennent à des genres différents (l'identification au niveau de l'espèce de Lb. brevis DSM 9296 devrait toutefois être confirmée). Dans les deux cas, le déterminant génétique de la production de la bactériocine et de l'immunité à celle-ci est porté par un plasmide, mais celui-ci est de plus grande taille (11 kpb) dans Lb. brevis DSM 9296 que dans P. acidilactici H (8,9 kpb). Il n'y a donc pas eu un simple transfert de plasmide entre les deux bactéries.
Concernant l'utilisation de la brévicine 9296 en vue de l'élimination de L. monocytogenes dans le fromage de Munster, ce résultat indique simplement qu'un tel traitement, certainement très efficace, n'a cependant rien d'innovant puisque cette bactériocine est connue depuis quelques années sous la dénomination de pédiocine AcH. Cette identité de structure entre les bactériocines produites par Lb. brevis DSM 9296 et P. acidilactici H n'enlève rien par contre à l'originalité du traitement des fromages de Munster par ensemencement de Lb. brevis DSM 9296. En effet, la production de la brévicine 9296 par celle-ci n'est pas dépendante du pH (du moins entre 5 et 7), alors que la production de pédiocine AcH (maturation de la pré-pédiocine) n'est possible qu'à un pH inférieur à 5,5, ce qui ne permettrait pas d'utiliser cette bactérie dans le traitement anti-Listeria des fromages de Munster. Il s'agit d'une observation qui laisse supposer que les systèmes enzymatiques de maturation post traduction des pré-bactériocines seraient différents chez les deux bactéries, ce qu'il serait intéressant de vérifier par une détermination du degré d'homologie entre les plasmides responsables de la production des bactériocines.
La troisième méthode proposée, le traitement par les rayonnements ionisants, ne paraissait a priori pas la solution la plus raisonnable. En effet, dans les produits laitiers, de très faibles doses d'ionisation sont susceptibles de développer dans l'aliment des modifications organoleptiques très préjudiciables. L'ionisation totale des fromages de Munster aux rayons X à la dose de 2,5 kGy (nécessaire puisque la contamination en L. monocytogenes peut atteindre 105 UFC/g et que la DRD de cette bactérie est d'environ 0,5 kGy) conduit effectivement à de telles altérations. Une réduction importante de la dose totale absorbée par l'aliment a cependant pu être obtenue du fait de la localisation exclusive de la bactérie pathogène dans la croûte et de la possibilité, dans ces conditions, de ne traiter qu'une faible épaisseur du fromage à l'aide d'électrons accélérés de faible énergie. Dans de telles conditions, le traitement ionisant des fromages de Munster naturellement contaminés à des concentrations allant jusqu'à 105 UFC/g, à l'issue de la période d'affinage et à la dose de 2,5 kGy, permet d'éliminer totalement L. monocytogenes. Aucune reprise de croissance n'a été observée lors du stockage ultérieur à 4C. Le traitement réalisé n'a pas entraîné de modifications organoleptiques notables, si ce n'est un léger jaunissement de la croûte.
L'ionisation des fromages de Munster par des électrons de faible énergie est donc un traitement anti-Listeria efficace. Comme par ailleurs elle est réalisée en fin d'affinage sur des fromages déjà emballés, les risques de recontamination sont nuls. Pour plusieurs raisons cependant, cette technique ne semble pas réellement intéresser les industriels : il y a d'abord le coût du traitement lui-même qui renchérie le prix du fromage ; il y a aussi les complications administratives liées à la demande d'autorisation de traitement, difficilement supportables par une petite ou moyenne entreprise industrielle (c'est le cas des différents fabricants de fromages de Munster) ; il y a enfin un problème d'ordre psychologique lié à l'utilisation alimentaire des rayonnements ionisant et un risque de rejet de l'aliment traité par le consommateur lorsque celui-ci verra apparaître sur l'emballage la mention "traité par rayonnement ionisant".
Le traitement direct par la bactériocine isolée de Lb. brevis DSM 9296 (brévicine 9296), éventuellement répété lors de l'affinage, présente l'avantage d'être efficace et simple d'utilisation, puisqu'il peut être réalisé à n'importe quel moment de l'affinage, lorsque la nécessité s'en fait sentir. Il faut cependant noter qu'il n'a rien d'innovant, puisque d'autres bactériocines anti-Listeria stables et actives entre pH 5 et pH 7 peuvent être adaptées à une utilisation dans le fromage de Munster. Dans un tel traitement, la bactériocine sera assimilée à un additif alimentaire avec tout les inconvénients que cela comporte sur le plan toxicologique (possibilité d'ajout de concentrations élevées) et réglementaire.
En définitive, le traitement préventif par ensemencement dans le fromage de Munster de souches bactériocinogènes anti-Listeria semble à la fois original (la bactérie n'étant pas ensemencée entant que starter) et plus satisfaisant. Le lactobacille Lb. brevis DSM 9296 étant présent naturellement et à des concentrations élevées dans cet aliment, tout comme l'entérocoque E. faecium 81, leur introduction dans le fromage de Munster sera donc d'une totale innocuité pour le consommateur (les cas d'infections dues aux entérocoques étant extrêmement rares (Batish et al., 1985 ; Fuller, 1989 ; Johnson, 1990)). L'efficacité du traitement est remarquable et n'entraîne aucune perturbation du processus d'affinage, ce qui n'est pas surprenant. Les excellents résultats obtenus lors d'expériences au laboratoire et partiellement en cave d'affinage ont d'ailleurs conduit certains industriels à utiliser cette technique en routine. Elle a donné entière satisfaction puisqu'après une année d'utilisation, L. monocytogenes n'a jamais été retrouvée dans les fromages. Mais il faut cependant être vigilant face aux risques de développement de variants de L. monocytogenes résistants à l'action de la bactériocine, bien que cela n'ait pas été rapporté dans le cadre de l'application de ces substances jusqu'ici (Eckner, 1992), et de variants de la souche bactériocinogène non producteurs de bactériocine.
Il ne faut pas oublier enfin que l'ensemencement de Lb. brevis DSM 9296 et d'E. faecium 81, idéal dans les conditions d'affinage des fromages de Munster, peut ne pas être appliqué de façon satisfaisante à d'autres aliments, en raison de l'activité chimique ou enzymatique, des caractéristiques physiques et microbiologiques et du traitement que subit chaque aliment. Cependant, des adaptations restent possibles, soit des bactéries (par transfert du plasmide de production à des souches technologiquement intéressantes et adaptées ou transfert de gènes codant pour des caractères particuliers à la souche bactériocinogène), soit des bactériocines par mutagenèse dirigée.